Wrodzone wady serca (CHD) u dzieci: przyczyny, objawy, rozpoznanie i leczenie. Wzorce zmian parametrów ultrasonograficznych we wrodzonych wadach serca u płodu w zależności od charakterystyki hemodynamiki wewnątrzsercowej przedporodowej
Jak wiesz, serce jest ważny narząd w organizmie człowieka od jego prawidłowego funkcjonowania zależy dobrostan całego organizmu. Serce składa się z mięśni (mięśnia sercowego) i tkanka łączna(zastawki serca, ściany duże naczynia). Czynność serca wynika z rytmicznych i sekwencyjnych skurczów jego struktur składowych (przedsionków i komór), w wyniku czego krew przepływająca przez płuca nasyca się tlenem (tzw. tlenu do wszystkich narządów i tkanek (krążenie ogólnoustrojowe).
Kiedy serce płodu rozwija się w czasie ciąży, działa inaczej niż serce noworodka i osoby dorosłej. W szczególności krążenie płucne zaczyna w pełni funkcjonować dopiero podczas porodu, kiedy płuca noworodka otwierają się, aw momencie pierwszego krzyku są wypełnione krwią. Dlatego w sercu płodu znajdują się specjalne otwory i przewody, które umożliwiają krążenie krwi w rozwijającym się organizmie, z pominięciem płuc ( przewód tętniczyłączący aortę i tętnica płucna, owalne okno między przedsionkami, przewód żylny między żyła pępowinowa i żyły głównej dolnej).
Czasem pod wpływem niekorzystne czynniki podczas Rozwój prenatalny występują rażące naruszenia kształtowania anatomicznych struktur serca, co wpływa na jego aktywność i nie zawsze jest zgodne z życiem dziecka. Następnie za pomocą USG płodu w czasie ciąży lub w pierwszych dniach po porodzie diagnozuje się noworodka wrodzona wada serca. Co to jest, jaka jest prognoza na całe życie i jakie są metody ratowania życia i zdrowia takich dzieci nowoczesna medycyna, postaramy się dowiedzieć w tym artykule.
Więc te stany patologiczne to duża grupa chorób serca, którą łączą następujące cechy:
Występują podczas rozwoju płodu;
- charakteryzuje się poważnymi naruszeniami architektury serca i dużych naczyń (aorta, żyła główna dolna i żyła główna, tętnica płucna i żyły);
- zmiany anatomiczne powodują znaczne zaburzenia hemodynamiki (krążenia krwi w organizmie);
- z powodu niedorozwoju struktur anatomicznych lub zmiany w ich budowie normalna lokalizacja w sercu.
Częstość występowania waha się od 6 do 9 na 1000 żywych urodzeń. Według różnych autorów, opcje Istnieje od 50 do 100 wrodzonych wad serca.
Schematyczne przedstawienie niektórych wad serca
Przyczyny wrodzonych wad serca
Ze względu na fakt, że podczas rozwoju wewnątrzmacicznego następuje aktywne tworzenie wszystkich narządów Ludzkie ciało, zwłaszcza serce, płód i kobieta w ciąży są narażone na działanie różnych negatywne czynniki. Tak więc wpływ na nieprawidłowy przebieg organogenezy może wywierać zwiększony tło promieniowania, promieniowanie jonizujące, choroba zakaźna matki, zwłaszcza wirusowe - różyczka, odra, ospa wietrzna, opryszczka; przyjmowanie niektórych leków i substancje toksyczne(narkotyki, alkohol) w czasie ciąży, zwłaszcza w pierwszym trymestrze ciąży (8-12 tygodni - okres najintensywniejszego tworzenia się wszystkich narządów płodu). W 4 - 10% przypadków wrodzone wady rozwojowe są uwarunkowane genetycznie, to znaczy są dziedziczone.
Objawy wrodzonych wad serca
Objawy kliniczne wad zależą od ich rodzaju. Przydziel defekty typu „niebieskiego” i „białego”, a także defekty, które utrudniają przepływ krwi.
główna manifestacja „niebieskie” wady(transpozycja (zmiana lokalizacji) główne arterie, tetralogia Fallota, atrezja – infekcja – zastawki trójdzielnej) to sinica – sine zabarwienie skóry palców rąk, stóp, trójkąta nosowo-wargowego, uszu, nosa lub w skrajnie ciężkich przypadkach całego ciała. Objawem hipoksemii tętniczej (niskiej zawartości tlenu) jest również duszność, utrata przytomności z drgawkami lub bez, tachykardia (kołatanie serca), opóźnienie wzrostu i rozwoju, częste przeziębienia, objawy neurologiczne spowodowane brakiem prawidłowego dopływu krwi do mózgu. Z reguły wady tego typu ujawniają się już w pierwszych godzinach i dniach życia noworodka. Transpozycja głównych tętnic (żyła główna wchodzi w lewo, nie prawy przedsionek, a aorta odchodzi od prawej, a nie lewej komory) jest poważną wadą nie do pogodzenia z życiem, a dziecko z reguły umiera zaraz po urodzeniu. Również serce trójkomorowe (dwa przedsionki i jedna komora lub jeden przedsionek i dwie komory) jest nie do pogodzenia z życiem. Śmiertelność wad tego typu jest bardzo duża, jeśli dzieci z takimi wadami przeżyją pierwsze dni życia, to bez leczenia umierają do końca pierwszego lub drugiego roku życia.
DO białe wady zawierać wadę przegrody międzykomorowej, otwarty przewód Botalłowa (tętniczy), defekt przegroda międzyprzedsionkowa. Klinicznie wady te mogą zacząć się objawiać nie we wczesnym dzieciństwie, ale w wieku 16-20 lat. Objawami wad typu białego są: bladość skóra, opóźnienie rozwoju, częste ostre wirusowe infekcje dróg oddechowych, objawy rozwijającej się niewydolności prawokomorowej - duszność i tachykardia podczas wysiłku lub w spoczynku.
Wady rozwojowe z niedrożnością przepływu krwi: zwężenie (zwężenie światła) aorty, koarktacja (odcinkowe zwężenie) aorty, zwężenie tętnicy płucnej objawiają się klinicznie dusznością, tachykardią, bólem w klatka piersiowa, zmniejszenie wytrzymałości, obrzęki, opóźnienie rozwoju i zaburzenia krążenia w dolnej połowie ciała. Przy koarktacji aorty dzieci dożywają maksymalnie 2 lat.
Diagnostyka wrodzonych wad serca
Z reguły możliwe jest zdiagnozowanie wad rozwojowych płodu, w tym wad serca, nawet na etapie badanie ultrasonograficzne kobieta w ciąży. Następnie, w zależności od rodzaju wady, kobiecie można zalecić albo przerwanie ciąży (w przypadku wad niezgodnych z życiem, mnogimi deformacjami itp.), albo kontynuację ciąży z dokładniejszym zbadaniem ciąży. kobiety i decyzji o leczeniu operacyjnym dziecka zaraz po urodzeniu lub po pewnym czasie. Ale czasami, z jakiegoś powodu (nie odwiedzając ciężarnej klinika przedporodowa i pracowni USG, niedostateczne wyposażenie stacji felczersko-położniczych w aparaturę USG itp.) wady rozwojowe można rozpoznać dopiero po porodzie.
Pomimo faktu, że objawy wrodzonych wad rozwojowych są dość żywe, w trakcie badanie kliniczne noworodkiem, rozpoznanie można jedynie założyć, ponieważ wiele objawów nie jest ściśle specyficznych, ale mogą być spowodowane innymi ciężkimi stanami noworodka ( Niewydolność oddechowa zespół, krwotoki śródczaszkowe itp.). Ponadto nie wszystkie wady mogą dawać charakterystyczny obraz osłuchowy (w trakcie słuchania klatki piersiowej) i odwrotnie, mogą wystąpić odgłosy, kliknięcia lub inne objawy osłuchowe z niewielkimi odchyleniami od normy w strukturze serca (małe anomalie ). W związku z tym, jeśli w badaniu USG płodu nie wykryto choroby serca, wszystkie dzieci z objawami zaburzeń krążenia (sinica rozlana lub akrocyjanoza, duszność podczas karmienia lub spoczynku, utrata przytomności, drgawki) powinny zostać poddane badaniu USG serca podczas pobytu w szpitalu położniczym.
Echokardiografia (USG serca) jest jedną z najbardziej metody informacyjne wizualizacja wad serca. Może być również przepisane EKG (wykazuje zaburzenia rytmu, przerost przedsionków i/lub komór, jeśli występuje), prześwietlenie klatki piersiowej (pokazuje zastój krwi w płucach, jeśli występuje, wzrost cienia serca z powodu ekspansji swoich komnatach). W szczególności trudne przypadki lub przed leczeniem chirurgicznym, ventrikulografia (wprowadzenie substancji nieprzepuszczającej promieni rentgenowskich do jamy komór serca), angiografia (wprowadzenie kontrastu przez naczynia do jamy serca), sondowanie komór serca z pomiarem ciśnienia w nich można przepisać.
Przyjrzyjmy się teraz bardziej szczegółowo diagnostyce ultrasonograficznej typowych wad serca.
A. wrodzone klapsy serca z przeciążeniem objętościowym naczyń w płucach (krążenie płucne).
1. Ubytek przegrody międzyprzedsionkowej - w echokardiografii jednowymiarowej stwierdza się objawy przeciążenia objętościowego i poszerzenia (rozszerzenia) prawej komory, w echokardiografii dwuwymiarowej widoczna jest przerwa w sygnale echa między przedsionkami, a w badaniu dopplerowskim badanie turbulentnego (z „zawirowaniami”) przepływu krwi przez przegrodę międzyprzedsionkową i stopnia zaburzeń krążenia płucnego.
2. Ubytek przegrody międzykomorowej – podczas USG serca uwidacznia się otwór w przegrodzie między komorami, poszerzenie lewej i prawej komory, turbulentny przepływ krwi z lewej do prawej komory, ocenia się stopień zaawansowania nadciśnienia płucnego, mierzy się różnicę ciśnień w komorach.

Tak objawia się ubytek przegrody międzykomorowej podczas echokardiografii dopplerowskiej. Po lewej prawidłowa przegroda międzykomorowa, po prawej jej ubytek (VSD).
3. Otwarty przewód Botalla - objawiający się w echokardiografii ciągłym przepływem krwi przez komunikację w aorcie i tętnicy płucnej, zmianą przepływu krwi u ujścia pnia płucnego.
4. Koarktacja aorty – widoczny segmentowy obszar zwężenia światła aorty, przyspieszony przepływ krwi poniżej segmentu.
5. Przełożenie głównych tętnic – uwidacznia się nieprawidłowy odpływ naczyń krwionośnych z serca.
B. Wady serca ze zmniejszeniem objętości krwi w krążeniu płucnym.
1. Tetralogia Fallota - za pomocą echokardiografii oprócz zwężenia (zwężenia) tętnicy płucnej i ubytku przegrody międzykomorowej określa się przerost prawej komory i wypływ aorty z prawej komory, ocenia się również stopień naruszenia hemodynamika wewnątrzsercowa.
2. Zwężenie tętnicy płucnej - stwierdza się zwężenie światła tętnicy płucnej, przyspieszenie przepływu krwi w ujściu tętnicy płucnej i przerost prawej komory.
3. Anomalia Epsteina - patologia rozwoju zastawki trójdzielnej serca, gdy płatki zastawki są przyczepione nie do włóknistego pierścienia między przedsionkiem a komorą po prawej stronie, ale do ścian prawej komory, co powoduje spadek w swojej objętości. Za pomocą ECHO - KG określa się patologię zastawki, ocenia się stopień ekspansji jam serca i naruszenie wewnątrzsercowego przepływu krwi.
4. Atrezja zastawki trójdzielnej - przy ECHO - CG brak odbicia sygnału echa od zastawki trójdzielnej, rejestruje się przerost prawego przedsionka i lewej komory.
B. Wady serca ze zmniejszeniem objętości krwi krążącej w krążeniu ogólnoustrojowym (w naczyniach wszystkich ważnych dla życia narządów).
1. Koarktacja aorty (patrz wyżej).
2. Izolowane zwężenie zastawki aortalnej - ocenia się stopień zwężenia, uwidacznia się przyspieszony przepływ krwi przez zastawkę aortalną oraz zdeformowane płatki zastawki.
D. Wady serca bez zaburzeń hemodynamicznych.
- Dekstrokardia (lustrzane ułożenie serca po prawej stronie) jest dość rzadką anomalią, z reguły zaburzenia hemodynamiczne nie są rejestrowane w USG serca.
Leczenie wrodzonych wad serca
Całkowite wyleczenie zdecydowanej większości wad serca jest możliwe tylko przy ich pomocy korekcja chirurgiczna. Kardiochirurgię można wykonać w pierwszych godzinach lub dniach życia noworodka lub w pierwszym roku życia dziecka. Przy otwartym przewodzie tętniczym dopuszczalne jest postępowanie wyczekujące (przy braku objawów stanu zagrażającego życiu), ponieważ przewód ten może się samoistnie zamknąć w pierwszych dwóch latach życia.
Operacje mogą być wykonywane jako otwarte serce(z rozcięciem ściany klatki piersiowej) oraz metodą sercowo-naczyniową (gdy dostęp do serca odbywa się poprzez wprowadzenie sondy do naczyń, która dociera do jam serca). Ostatnia metoda stosuje się go np. w korekcji ubytków między przedsionkami lub komorami, do których za pomocą sondy wprowadza się okluder w celu zamknięcia otworów.
Ale w przypadku niektórych wad serca, które nie są zgodne z życiem, na przykład serca trójkomorowego (jeden przedsionek i dwie komory lub dwa przedsionki i jedna komora), korekcja chirurgiczna niestety nie jest możliwa.
Oprócz operacji kardiochirurgicznej pacjent jest przepisywany terapia lekowa dla ulepszenia funkcja skurczowa serce i „rozładowanie” krążenia płucnego. Stosuje się inhibitory ACE (enalapryl, peryndopryl, lizynopryl, ramipryl itp.), Diuretyki (furosemid, indapamid itp.), B-blokery (karwedilol, bisoprolol itp.).
Styl życia z wrodzoną wadą serca
Pacjent musi przestrzegać następujące zalecenia odnośnie jego stylu życia:
- racjonalnie zbilansowane odżywianie;
- przestrzeganie restrykcyjnej diety sól kuchenna oraz objętość spożywanych płynów (w celu zmniejszenia przeciążenia objętościowego serca i naczyń krwionośnych);
- Wystarczająca ekspozycja na świeże powietrze;
- wykluczenie wszelkich zajęć sportowych i ograniczenie sił aktywność fizyczna;
- Wystarczający czas snu;
- regularne monitorowanie przez kardiologa i kardiochirurga z niezbędnymi środkami terapeutycznymi i diagnostycznymi;
- ciąża u kobiet z wadami typu "niebieskiego" jest ściśle przeciwwskazana, ale jeśli została przeprowadzona chirurgia, wówczas możliwość utrzymania ciąży ustalana jest każdorazowo indywidualnie przy wspólnym prowadzeniu ciężarnej przez kardiochirurga, kardiologa i położnika-ginekologa w szpitalu specjalistycznym. Poród odbywa się zwykle przez cesarskie cięcie.
Rokowanie w przypadku wrodzonych wad serca
Rokowanie w życiu większości wad serca jest niekorzystne. Jak już wspomniano powyżej, leczenie kardiochirurgiczne takie dzieci są wymagane w pierwszych dniach i miesiącach po porodzie, w przeciwnym razie umierają w ciągu pierwszych dwóch lat z powodu progresji niewydolności serca lub dodania powikłań ( bakteryjne zapalenie wsierdziaśmiertelne arytmie, zwiększone ryzyko zakrzepica i powikłania zakrzepowo-zatorowe, częste choroby układ oskrzelowo-płucny(przewlekłe zapalenie oskrzeli, ciężkie zapalenie płuc). Wyjątkiem są białe wady, w których przy braku leczenia chirurgicznego z jakiegokolwiek powodu dzieci są w stanie dożyć 16-18 lat.
Po korekcji chirurgicznej rokowanie na całe życie jest pomyślne, ale mimo to stan dziecka pozostaje dość poważny, dlatego takie dzieci powinny być pod ścisłą obserwacją rodziców i lekarzy.
Podsumowując, chciałbym zauważyć, że ta diagnoza u dziecka obecny etap Rozwój medycyny to nie wyrok, gdyż możliwości rodzimej i zagranicznej kardiologii dzieciństwa pozwalają znieść, urodzić i wychować dziecko, które mimo tak poważnej choroby jest w stanie wieść pełnię życia.
Terapeuta Sazykina O.Yu.
Jedna z najczęściej diagnozowanych anomalii rozwojowych układu sercowo-naczyniowego dzieci uważa się za wrodzoną wadę serca. Takie anatomiczne naruszenie budowy mięśnia sercowego, które występuje w okresie wewnątrzmacicznego rozwoju płodu, grozi poważnymi konsekwencjami dla zdrowia i życia dziecka. Wczesna interwencja medyczna może pomóc w uniknięciu tragicznego wyniku choroby niedokrwiennej serca u dzieci.
Zadaniem rodziców jest nawigacja w etiologii choroby i poznanie jej głównych objawów. Na mocy cechy fizjologiczne noworodków, niektóre patologie serca są trudne do zdiagnozowania zaraz po urodzeniu dziecka. Dlatego musisz uważnie monitorować stan zdrowia rosnącego dziecka, reagować na wszelkie zmiany.
Klasyfikacja wrodzonych wad serca u dzieci
Wrodzona choroba serca powoduje naruszenie przepływu krwi przez naczynia lub w mięśniu sercowym.
Im wcześniej zostanie wykryta wrodzona wada serca, tym korzystniejsze rokowanie i wynik leczenia choroby.
W zależności od manifestacje zewnętrzne patologie rozróżniają następujące typy CHD:
- „Białe” (lub „blade”) wady
Takie wady są trudne do zdiagnozowania ze względu na brak oczywiste objawy. Charakterystyczną zmianą jest bladość skóry u dziecka. To może sygnalizować przybycie niewystarczająco krew tętnicza w tkance.
- „Niebieskie” wady
 Głównym przejawem tej kategorii patologii jest niebieski kolor skóry, szczególnie zauważalny w okolicy uszu, warg i palców. Takie zmiany są spowodowane niedotlenieniem tkanek, wywołanym mieszaniem się krwi tętniczej i żylnej.
Głównym przejawem tej kategorii patologii jest niebieski kolor skóry, szczególnie zauważalny w okolicy uszu, warg i palców. Takie zmiany są spowodowane niedotlenieniem tkanek, wywołanym mieszaniem się krwi tętniczej i żylnej.
Do grupy wad „niebieskich” zalicza się przełożenie aorty i tętnicy płucnej, anomalię Ebsteina (przemieszczenie miejsca przyczepu płatków zastawki trójdzielnej do jamy prawej komory), tetradę Fallota (tzw. połączona wada, która łączy cztery patologie - zwężenie odcinka wyjściowego prawej komory, dekstropozycja aorty, przerost prawej i górnej komory).
Ze względu na charakter zaburzeń krążenia wrodzone wady serca u dzieci dzieli się na następujące typy:
- Wiadomość z przeciekiem krwi od lewej do prawej (otwarty przewód tętniczy, ubytek międzykomorowy lub przegrody międzyprzedsionkowej).
- Komunikacja bocznikowa od prawej do lewej (atrezja zastawki trójdzielnej).
- Wady serca bez przecieku krwi (zwężenie lub koarktacja aorty, zwężenie tętnicy płucnej).
W zależności od złożoności naruszenia anatomii mięśnia sercowego wyróżnia się takie wrodzone wady serca dzieciństwo:
- defekty proste (wady pojedyncze);
- złożony (połączenie dwóch zmian patologicznych, na przykład zwężenie otworów serca i niewydolność zastawek);
- defekty złożone (kombinacje wielu anomalii, które są trudne do leczenia).
Przyczyny patologii
Naruszenie różnicowania serca i pojawienie się CHD u płodu wywołuje wpływ niekorzystnych czynników środowisko na kobietę w okresie rozrodczym.
Do głównych przyczyn, które mogą powodować wady serca u dzieci w okresie ich rozwoju prenatalnego, należą:
- zaburzenia genetyczne (mutacje chromosomów);
- palenie tytoniu, spożywanie alkoholu, środków odurzających i toksycznych przez kobietę w okresie rodzenia dziecka;
- cierpiała w czasie ciąży choroba zakaźna(wirus różyczki i grypy, ospa wietrzna, zapalenie wątroby, enterowirus itp.);
- niekorzystne warunki środowiskowe (podwyższone promieniowanie tła, wysoki poziom zanieczyszczenie powietrza itp.);
- zażywania narkotyków, których przyjmowanie jest zabronione w czasie ciąży (także narkotyków, których wpływ i skutki uboczne słabo zbadane).
- czynniki dziedziczne;
- somatyczne patologie matki (głównie cukrzyca).
Są to główne czynniki prowokujące występowanie chorób serca u dzieci w okresie ich rozwoju prenatalnego. Ale są też grupy ryzyka – są to dzieci, zrodzony z kobiet powyżej 35 roku życia, a także cierpiących na dysfunkcje endokrynologiczne lub zatrucia pierwszego trymestru.
Objawy wrodzonej wady serca
Już w pierwszych godzinach życia ciało dziecka może sygnalizować nieprawidłowości w rozwoju układu sercowo-naczyniowego. Wskazują na arytmię, kołatanie serca, trudności w oddychaniu, utratę przytomności, osłabienie, sinicę lub bladość skóry możliwe patologie kiery.
Ale objawy CHD mogą pojawić się znacznie później. obawy rodziców i natychmiastowe odwołanie za opieka medyczna powinno spowodować takie zmiany w stanie zdrowia dziecka:
- niebieska lub niezdrowa bladość skóry w okolicy trójkąta nosowo-wargowego, stóp, palców, uszu i twarzy;
- trudności z karmieniem dziecka, słaby apetyt;
- opóźnienie w przybieraniu na wadze i wzroście dziecka;
- obrzęk kończyn;
- zwiększone zmęczenie i senność;
- półomdlały;
- zwiększone pocenie się;
- duszność (utrzymujące się trudności w oddychaniu lub przejściowe drgawki);
- zmiany częstości akcji serca niezależne od stresu emocjonalnego i fizycznego;
- szmery w sercu (określone przez słuchanie lekarza);
- ból w sercu, klatce piersiowej.
W niektórych przypadkach wady serca u dzieci przebiegają bezobjawowo. Utrudnia to wykrycie choroby we wczesnych stadiach.
 Regularne wizyty u pediatry pomogą zapobiec zaostrzeniu choroby i rozwojowi powikłań. Przy każdym planowanym badaniu lekarz musi osłuchać ton tonów serca dziecka, sprawdzając obecność lub brak szmerów – niespecyficznych zmian, które często mają charakter czynnościowy i nie stanowią zagrożenia dla życia. Do 50% szmerów wykrytych podczas badania pediatrycznego mogą towarzyszyć „niewielkie” wady, które nie wymagają interwencja chirurgiczna. W takim przypadku wskazane są regularne wizyty, monitorowanie i konsultacje z kardiologiem dziecięcym.
Regularne wizyty u pediatry pomogą zapobiec zaostrzeniu choroby i rozwojowi powikłań. Przy każdym planowanym badaniu lekarz musi osłuchać ton tonów serca dziecka, sprawdzając obecność lub brak szmerów – niespecyficznych zmian, które często mają charakter czynnościowy i nie stanowią zagrożenia dla życia. Do 50% szmerów wykrytych podczas badania pediatrycznego mogą towarzyszyć „niewielkie” wady, które nie wymagają interwencja chirurgiczna. W takim przypadku wskazane są regularne wizyty, monitorowanie i konsultacje z kardiologiem dziecięcym.
Jeśli lekarz wątpi w pochodzenie takich dźwięków lub obserwuje zmiany patologiczne zdrowy, dziecko należy skierować na badanie kardiologiczne. Kardiolog dziecięcy ponownie słucha serca i przepisuje dodatkowe badania diagnostyczne w celu potwierdzenia lub obalenia wstępnej diagnozy.
Objawy choroby w różne stopnie Trudności nie ograniczają się do noworodków. Imadła mogą najpierw dać się odczuć już w środku adolescencja. Jeśli dziecko, na zewnątrz wyglądające na absolutnie zdrowe i aktywne, wykazuje oznaki opóźnienia rozwojowego, niebieską lub bolesną bladość skóry, duszności i zmęczenie nawet przy niewielkich obciążeniach, konieczne jest badanie pediatry i konsultacja kardiologa.
Metody diagnostyczne
Aby zbadać stan mięśnia sercowego i zastawek, a także zidentyfikować nieprawidłowości w krążeniu, lekarze stosują następujące metody:
- Echokardiografia to badanie ultrasonograficzne, które dostarcza danych na temat patologii serca i jego wewnętrznej hemodynamiki.
- Elektrokardiogram - diagnostyka zaburzeń rytmu serca.
- Fonokardiografia - wyświetlanie tonów serca w postaci wykresów, które pozwalają poznać wszystkie niuanse, które nie są dostępne podczas słuchania uchem.
- z dopplerem – techniką pozwalającą lekarzowi na wizualną ocenę procesów przepływu krwi, stanu zastawek serca i naczynia wieńcowe poprzez przymocowanie specjalnych czujników do obszaru klatki piersiowej pacjenta.
- Kardiorytmografia to badanie charakterystyki struktury i funkcji układu sercowo-naczyniowego, jego autonomicznej regulacji.
- Cewnikowanie serca - wprowadzenie cewnika do prawego lub lewego serca w celu określenia ciśnienia w jamach. Podczas tego badania wykonuje się także ventrikulografię - badanie rentgenowskie komory serca z wprowadzeniem środków kontrastowych.
Każda z tych metod nie jest stosowana przez lekarza w izolacji - w celu dokładnego rozpoznania patologii wyniki są porównywane różne studia, pozwalając na ustalenie głównych naruszeń hemodynamiki.
 Na podstawie uzyskanych danych kardiolog określa anatomiczny wariant anomalii, określa fazę przebiegu oraz prognozuje możliwe komplikacje choroba serca u dziecka.
Na podstawie uzyskanych danych kardiolog określa anatomiczny wariant anomalii, określa fazę przebiegu oraz prognozuje możliwe komplikacje choroba serca u dziecka.
Jeżeli w rodzinie któregoś z przyszłych rodziców wystąpiły wady serca, to ciało kobiety w okresie rodzenia dziecka zostało poddane co najmniej jednemu z niebezpieczne czynniki Lub przyszłe dziecko być zagrożonym możliwy rozwój CHD, wówczas ciężarna powinna uprzedzić o tym obserwującego ją lekarza położnika-ginekologa.
Lekarz, biorąc pod uwagę te informacje, powinien Specjalna uwaga zwróć uwagę na obecność objawów nieprawidłowości serca u płodu, zastosuj wszystkie możliwe środki rozpoznanie choroby w okresie prenatalnym. Zadanie przyszła mama- terminowo poddawać się USG i innym badaniom zaleconym przez lekarza.
Najlepsze wyniki daje dokładne dane dotyczące stanu układu sercowo-naczyniowego najnowszy sprzęt do diagnostyki dziecięcych wad serca.
Leczenie wrodzonych wad serca u dzieci
Wrodzone wady serca w dzieciństwie leczy się na dwa sposoby:
- Interwencja chirurgiczna.
- Procedury terapeutyczne.
![]() W większości przypadków jedyną możliwą szansą na uratowanie życia dziecka jest właśnie pierwsza radykalna metoda. Badanie płodu na obecność patologii układu sercowo-naczyniowego przeprowadza się jeszcze przed jego urodzeniem, dlatego najczęściej kwestia wyznaczenia operacji jest podejmowana w tym okresie.
W większości przypadków jedyną możliwą szansą na uratowanie życia dziecka jest właśnie pierwsza radykalna metoda. Badanie płodu na obecność patologii układu sercowo-naczyniowego przeprowadza się jeszcze przed jego urodzeniem, dlatego najczęściej kwestia wyznaczenia operacji jest podejmowana w tym okresie.
Poród w tym przypadku odbywa się w specjalistycznych oddziałach położniczych działających w szpitalach kardiochirurgicznych. Jeśli operacja nie zostanie przeprowadzona natychmiast po urodzeniu dziecka, zaleca się leczenie chirurgiczne tak szybko, jak to możliwe. krótki czas najlepiej w pierwszym roku życia. Takie środki są podyktowane koniecznością ochrony organizmu przed rozwojem ewentualnych zagrażających życiu konsekwencji CHD - niewydolności serca i.
Nowoczesna kardiochirurgia obejmuje zarówno operacje na otwartym sercu, jak i metodę cewnikowania, uzupełnioną badaniem rentgenowskim i echokardiografią przezprzełykową. Eliminację ubytków w wadach serca skutecznie przeprowadza się za pomocą plastyki balonowej, leczenia wewnątrznaczyniowego (metody wprowadzania ścianek i instrumentów uszczelniających). W połączeniu z operacją pacjent jest przepisywany leki które zwiększają skuteczność leczenia.
Procedury terapeutyczne są metoda pomocnicza zwalczania choroby i są stosowane, gdy istnieje możliwość lub konieczność przeniesienia operacji na więcej późne terminy. Leczenie terapeutyczne często polecany przy wadach „bladych”, jeśli choroba nie rozwija się gwałtownie miesiącami i latami, nie zagraża życiu dziecka.
W okresie dojrzewania mogą rozwinąć się nabyte wady serca u dzieci – połączenie skorygowanych wad i nowo pojawiających się anomalii. Dlatego dziecko, które przeszło chirurgiczną korekcję patologii, może później potrzebować drugiej interwencji chirurgicznej. Operacje takie najczęściej wykonuje się oszczędną, małoinwazyjną metodą w celu wyeliminowania obciążenia psychiki i organizmu dziecka jako całości oraz uniknięcia blizn.
W leczeniu złożonych wad serca lekarze nie ograniczają się do metody naprawcze. Aby ustabilizować stan dziecka, wyeliminować zagrożenie życia i zmaksymalizować czas jego trwania dla pacjenta, konieczne jest wykonanie szeregu procedur krok po kroku. interwencje chirurgiczne z zapewnieniem pełnego ukrwienia organizmu, aw szczególności płuc.
Terminowe wykrywanie i leczenie wad wrodzonych i chorób serca u dzieci umożliwia większości młodych pacjentów pełny rozwój, prowadzenie aktywny obraz podtrzymywania życia zdrowy stan ciała i nie czuć się naruszonym moralnie ani fizycznie.
Nawet po udanej operacji i najkorzystniejszych rokowaniach lekarskich głównym zadaniem rodziców jest zapewnienie dziecku regularnych wizyt i badań przez kardiologa dziecięcego.
wady wrodzone serca rzadko wpływają na rozwój płodu. Zostało to po raz pierwszy zauważone w badaniach B. Mac Mahona i in. . Są jednak wady, które są nie do pogodzenia z życiem, a po urodzeniu dziecko natychmiast umiera. Nawet niektóre wrodzone wady serca proste formy, we wczesnym okresie noworodkowym są złośliwe, powodując rozwój dekompensacji krążenia i niewydolność oddechowa. główny powód To jest niedoskonałość mechanizmów kompensacyjnych.
Diagnostyka płodu jest jednym z najtrudniejszych zadań perinatologii. Wiele wrodzonych wad serca, nawet złożonych, praktycznie niezgodnych z życiem, nie objawia się prenatalnie ze względu na specyfikę hemodynamiki wewnątrzsercowej i staje się katastrofą dla życia dziecka po urodzeniu.
Okres przedporodowy charakteryzuje się cechami krążenia, takimi jak podwyższone ciśnienie w prawej komorze, niewielki przepływ krwi w tętnicy płucnej, równoległa praca komór serca, funkcjonujący przewód tętniczy i otwór owalny, pompowanie krwi w postaci zespoleń bajpasowych do krążenie ogólnoustrojowe dzięki ciężka praca prawy żołądek. Te cechy hemodynamiki wewnątrzsercowej płodu powinny oczywiście korygować charakter zmian hemodynamicznych. wskaźniki ultradźwiękowe z prawidłowym sercem oraz z wadami serca u płodu.
Wiadomo, że u pacjentów z wrodzonymi wadami serca dochodzi do zaburzeń hemodynamicznych w wyniku zmiany anatomiczne V w dużej mierze wpływać na dane badanie ultrasonograficzne serce, takie jak wielkość jam serca, stopień przerostu mięśnia sercowego, czynność aparatu zastawkowego, kurczliwość mięśnia sercowego, kierunek ruchu przegrody międzykomorowej.
Metoda oceny hemodynamiki wewnątrzsercowej opiera się na znanych koncepcjach przeciążenia skurczowego, objętościowego i mieszanego serca, zaproponowanych w 1952 r. przez E. Cabrerę i J. Monroya.
Podział opiera się na następującej zasadzie.
Obciążenie oporowe występuje, gdy wyrzut krwi z komór serca do głównych naczyń jest utrudniony na poziomie zastawek półksiężycowatych (zwężenie aorty i tętnicy płucnej), przestrzeni podzastawkowej (idiopatyczne przerostowe zwężenie podaortalne, podzastawkowe zwężenie aorty) lub tętnicy płucnej), wzdłuż łożyska naczyniowego (aorta koarktacyjna) lub ze znacznym wzrostem oporu wyjściowego (zespół Eisenmengera). W wyniku trudności z wyrzutem krwi napięcie mięśnia sercowego odpowiedniej komory gwałtownie wzrasta przy względnie stabilnej objętości krwi, co jest przejawem skurczowego przeciążenia serca. Przy skurczowym przeciążeniu komór serca, niezależnie od nozologicznej postaci wady, wnęka komory, która przenosi główny ładunek z oporem, umiarkowanie zwiększa rozmiar. W odpowiedzi na obciążenie oporowe echokardiogram ujawnia przerost mięśnia sercowego odpowiedniej komory, a im większy opór wyrzutowy, tym wyraźniejszy stopień przerostu mięśnia sercowego odpowiedniej komory i przegrody międzykomorowej (ryc. 1).
Ryż. 1. Skurczowe przeciążenie prawej komory. Przekrój komór serca w zwężeniu tętnicy płucnej. Gradient ciśnienia prawa komora - tętnica płucna wynosi 200 mm Hg. Ciężki przerost przegrody międzykomorowej i mięśnia sercowego przedniej ściany prawej komory.
IVS - przegroda międzykomorowa, MRV - mięsień sercowy prawej komory, RV - prawa komora.
Obciążenie objętościowe występuje przy dodatkowym napływie krwi do komór oraz w wyniku przetaczania krwi przez przegrody przegrody lub przewód tętniczy (ubytki w przegrodzie międzyprzedsionkowej i międzykomorowej, przetrwały przewód tętniczy), a także w wyniku wstecznego przepływu krwi przez zastawki przedsionkowo-komorowe (niedomykalność zastawek).
Cechą charakterystyczną ciężkiego przeciążenia objętościowego prawej komory jest rozstrzenie komory, w którym grubość mięśnia sercowego nie przekracza Górna granica normy, wzrost prawego przedsionka, paradoksalny charakter ruchu przegrody międzykomorowej i wzrost amplitudy ruchu zastawki trójdzielnej (ryc. 2, 3).

Ryż. 2. Długa oś serca. Przeciążenie objętościowe prawej komory w ubytku w przegrodzie międzyprzedsionkowej. Objętość przelanej krwi przekracza 200% MOS. Odnotowuje się wyraźne poszerzenie prawej komory.
RV - prawa komora, AO - aorta, LA - lewy przedsionek, MV - zastawka mitralna.

Ryż. 3. Przeciążenie objętościowe prawej komory w ubytku w przegrodzie międzyprzedsionkowej. Skan B i M. Strzałka pokazuje paradoksalny charakter ruchu przegrody międzykomorowej.
W przypadku lewej komory objawem przeciążenia objętościowego jest powiększenie jamy lewego przedsionka i komory, a także wychylenia przegrody międzykomorowej i mięśnia sercowego. tylna ściana lewej komory (ryc. 4).
IVS - przegroda międzykomorowa, MLV - mięsień sercowy lewej komory, LV i RV - lewa i prawa komora.
W przypadku połączenia obciążenia oporowego i objętości dochodzi do przeciążenia mieszanego (na przykład z ubytkiem przegrody międzykomorowej i wzrostem ciśnienia w tętnicy płucnej dla prawej komory, przeciążenie skurczowe łączy się z obciążeniem objętościowym, w wyniku czego dla lewej komory tętniczego przetaczania żylnego krwi przez ubytek).
Przez długi okres (od 1980 do chwili obecnej) obserwacji na Federal State University Centrum naukowe położnictwa i perinatologii W I. Kułakowa z Ministerstwa Zdrowia i Rozwoju Społecznego Rosji zauważono, że w okresie przedporodowym zasady hemodynamicznych echokardiograficznych objawów wrodzonych wad serca, które zostały wcześniej opracowane i przedstawione we współczesnej literaturze, nie zawsze działają.
Analiza ponad 2000 obserwacji wrodzonych wad serca u płodu wykazała, że w wielu przypadkach występują jedynie zmiany anatomiczne charakterystyczne dla określonej nozologicznej postaci wady. W innych wrodzonych wadach serca zmiany w echokardiogramie są związane z charakterem obciążenia hemodynamicznego serca i są podobne do obserwowanych po urodzeniu. Wreszcie w szeregu obserwacji wrodzonych wad serca u płodu zmiany wtórne na echokardiogramie, spowodowane zaburzeniami hemodynamicznymi, różnią się od hemodynamicznych objawów USG u dzieci i dorosłych. Umożliwiło to podzielenie wszystkich wrodzonych wad serca płodu na trzy grupy w zależności od zmian w echokardiogramie wynikających ze specyfiki przedporodowej hemodynamiki wewnątrzsercowej.
Pierwsza grupa obejmowała wady serca, które mając wyraźne anatomiczne objawy patologii, nie mają hemodynamicznych objawów wrodzonej wady serca w badaniu ultrasonograficznym. Należą do nich: ubytek przegrody międzyprzedsionkowej, ubytek przegrody międzykomorowej, komora wspólna, prosta postać transpozycji naczynia główne a także w obecności ubytku przegrody międzykomorowej, wspólnego pnia tętniczego, podwójnego wyładowania naczyń z komór serca.
Należy to przeanalizować na przykładzie ubytku w przegrodzie międzyprzedsionkowej. Podstawą zaburzeń hemodynamiki wewnątrzsercowej w ubytku w przegrodzie międzyprzedsionkowej jest przeciążenie objętościowe prawego serca. W przypadku USG u dzieci i dorosłych prowadzi to do:
- poszerzenie prawej komory (patrz ryc. 2, 3);
- powiększenie prawego przedsionka;
- paradoksalny charakter ruchu przegrody międzykomorowej (patrz ryc. 2, 3).
Przedporodowo, przy równych ciśnieniach w komorach serca i przedsionkach, nie dochodzi do przeciążenia objętościowego. Pod tym względem żaden z echokardiograficznych objawów hemodynamicznych stosowanych u dzieci i dorosłych nie jest wykrywany u płodu. Echokardiograficzne objawy wady są przedporodowe tylko bezpośrednim znakiem - przerwa w wiązce ultradźwiękowej w obszarze wady. Wielkość serca, stosunek wielkości komór serca nie odbiegają od normy (ryc. 5).
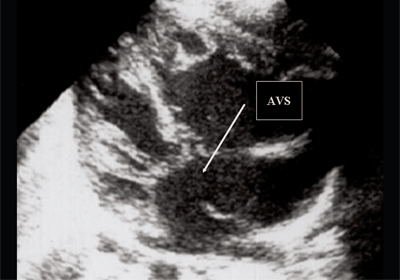
Ryż. 5. Przekrój czterokomorowy serca płodu. Strzałka wskazuje na pierwotny ubytek przegrody międzyprzedsionkowej (AVS).
Dotyczy to w równym stopniu ubytku w przegrodzie międzykomorowej (ryc. 6), prostej postaci przełożenia wielkich naczyń (ryc. 7, 8), przełożenia wielkich naczyń z ubytkiem w przegrodzie międzykomorowej (zespół Taussiga-Binga) (ryc. 9), wspólna komora ( ryc. 10), ogólnie pnia tętniczego(ryc. 10), podwójny wypływ naczyń z jednej z komór serca (ryc. 11).
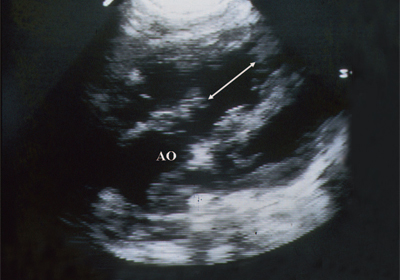
Ryż. 6. Ubytek przegrody międzykomorowej. Długa oś serca. Strzałki wskazują na ubytek przegrody międzykomorowej.
AO - aorta.
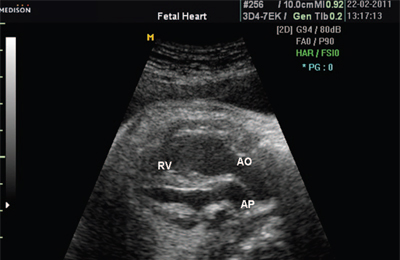
Ryż. 7. Transpozycja wielkich naczyń.
AR - tętnica płucna, AO - aorta, RV - prawa komora.

Ryż. 8. Transpozycja dużych naczyń, strzałki pokazują gałęzie tętnicy płucnej.
AR - tętnica płucna, LV - lewa komora.
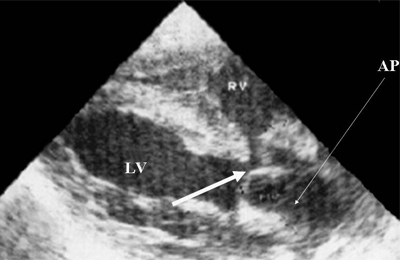
Ryż. 9. Zespół Taussiga-Binga. Tętnica płucna (zaznaczona strzałką) znajduje się powyżej ubytku przegrody międzykomorowej.
AR - tętnica płucna, LV i RV - lewa i prawa komora.
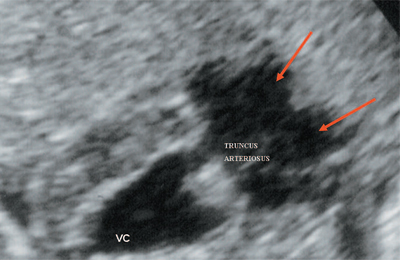
Ryż. 10. Komora wspólna pochodzenia TRUNCUS ARTERIOSUS. Strzałki pokazują podział TRUNCUS ARTERIOSUS na aortę i pień tętnicy płucnej.
VC - wspólna komora, TRUNCUS ARTERIOSUS - wspólny pień tętniczy.

Ryż. jedenaście. Podwójne rozładowanie głównych naczyń z lewej komory. Długa oś serca. Główne naczynia są odwrócone i odchodzą od lewej komory. Aorta położona jest „górą” nad ubytkiem przegrody międzykomorowej (strzałka).
LV i RV – lewa i prawa komora, AR – tętnica płucna, AO – aorta, VSD – ubytek przegrody międzykomorowej.
Tak więc rozpoznanie wymienionych powyżej wrodzonych wad serca opiera się na znajomości zmian anatomicznych charakterystycznych dla określonej nozologicznej postaci patologii.
Druga grupa wrodzonych wad serca. Badanie ultrasonograficzne rejestruje zmiany anatomiczne i hemodynamiczne charakterystyczne dla określonej nozologicznej postaci wady. Do tej grupy zaliczono: zwężenie zastawki aortalnej, zwężenie tętnicy płucnej, wrodzone zwężenie zastawki dwudzielnej przełożenie dużych naczyń ze zwężeniem tętnicy płucnej, guzowa niedrożność drogi odpływu jednej z komór, anomalia Ebsteina, zespół hipoplazji prawej i lewej komory serca, włóknienie sprężyste, przedwczesne zamknięcie otworu owalnego.
Jako przykład można przeanalizować zmiany parametrów echokardiograficznych w zwężeniu zastawki tętnicy płucnej. Naruszenie hemodynamiki w izolowanym zwężeniu tętnicy płucnej jest spowodowane przeszkodą w wyrzucaniu krwi do tętnicy płucnej. Nasilenie zwężenia zależy od różnicy ciśnienie skurczowe w prawej komorze i tętnicy płucnej, tj. gradient ciśnienia.
Dzięki dwuwymiarowemu pogrubieniu guzków zastawki płucnej ich ruch jest zmniejszony, aw skurczu tworzą kopułę. Są to anatomiczne objawy wady. Dodaje się do nich objawy hemodynamiczne: wyraźny przerost mięśnia sercowego przedniej ściany prawej komory i przegrody międzykomorowej, znacznie przekraczający normy. Nasilenie przerostu mięśnia sercowego prawej komory zależy od stopnia zwężenia tętnicy płucnej i odpowiednio od wielkości gradientu ciśnienia. Dane te uzyskano porównując wyniki badań ultrasonograficznych z danymi dotyczącymi cewnikowania jam serca u dzieci. Należy szczególnie zauważyć, że przy ciężkim przeroście mięśnia sercowego jama prawej komory nieznacznie się zwiększa. Występuje również wzrost wielkości prawego przedsionka.
Podobne zmiany uzyskano u płodu, które również zależały od stopnia zwężenia tętnicy płucnej. Jama prawej komory, jak widać na ryc. 12 nie jest powiększony. Jednocześnie dochodzi do znacznego przerostu ścian prawej komory. Jak w okres poporodowy wyraźny wzrost jamy prawego przedsionka (ryc. 13). Cewnikowanie jam serca po urodzeniu w tej obserwacji wykazało gradient ciśnienia na wylocie z prawej komory równy 200 mm Hg.
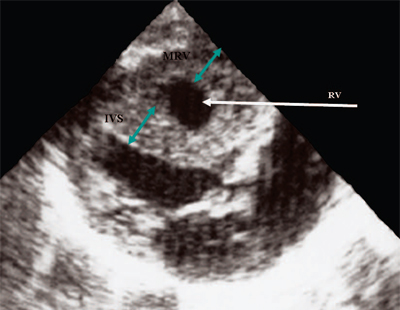
Ryż. 12. Zwężenie tętnicy płucnej. Przerost mięśnia sercowego prawej komory.
RV - prawa komora, IVS - przegroda międzykomorowa, MRV - mięsień sercowy prawej komory.
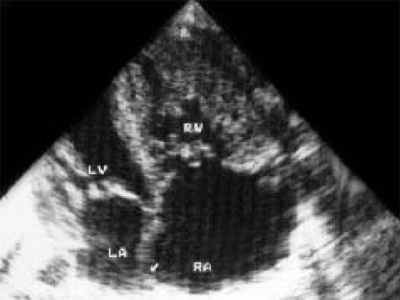
Ryż. 13. Wyrażone zwężenie tętnicy płucnej. Przekrój czterokomorowy serca. Znaczny wzrost jamy prawego przedsionka.
Taki związek z zaburzeniami hemodynamiki wewnątrzsercowej u płodu można oczywiście wykryć tylko przy wyraźnym naruszeniu odpływu krwi z prawej komory do tętnicy płucnej, ponieważ płucny przepływ krwi w okresie przedporodowym wynosi od 12 do 20%. Reszta krwi przepływa przez przewód tętniczy do aorty zstępującej. Dlatego niewielkie zwężenie tętnicy płucnej nie jest tak pouczające pod względem hemodynamicznych objawów ultrasonograficznych.
W przypadku anomalii Ebsteina diagnostyka prenatalna, podobnie jak w okresie postnatalnym, opiera się na ustaleniu położenia zastawki trójdzielnej względem zastawki mitralnej i jej przemieszczeniu w głąb prawej komory. Podczas badania zwróć uwagę duże rozmiary serca, głównie z powodu prawego przedsionka (ryc. 14). Kardiografia dopplerowska wykazała niedomykalność zastawki trójdzielnej.

Ryż. 14. Anomalia Ebsteina. Przekrój czterokomorowy serca. Występuje przemieszczenie zastawki trójdzielnej w kierunku koniuszka prawej komory.
LV i RV – lewa i prawa komora, RA – prawy przedsionek, TV – zastawka trójdzielna, MV – zastawka mitralna.
Niewielkie zwężenie zastawki aortalnej nie powoduje zaburzeń hemodynamicznych u płodu. Przy znacznej przeszkodzie w wyrzucaniu krwi z lewej komory ciśnienie w niej wzrasta, a praca lewej komory wzrasta. W przypadku znacznego zwężenia znacznie wzrasta opór na wyrzut krwi, wzrasta również ciśnienie w lewym przedsionku i pojawia się przeciek lewo-prawo krwi przez otwór owalny, w przeciwieństwie do normalnego dla płodu przecieku prawo-lewo. Powoduje to objawy niewydolności serca i może powodować opóźnienie wewnątrzmaciczne rozwój .
W badaniu ultrasonograficznym stwierdzono wyraźny przerost mięśnia sercowego lewej komory (ryc. 15). Rozmiar lewego przedsionka wzrasta. Można zarejestrować niedomykalność zastawki mitralnej.
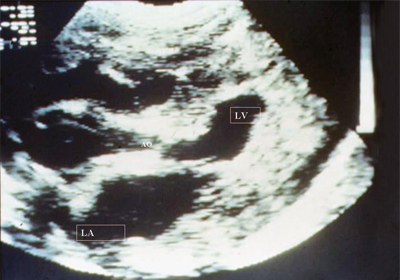
Ryż. 15. Zwężenie zastawki aortalnej. Długa oś serca. Odnotowuje się wyraźne zwężenie otworu aorty, wyraźny przerost mięśnia sercowego lewej komory, zmniejszenie jej jamy i poszerzenie lewego przedsionka.
LV - lewa komora, LA - lewy przedsionek, AO - aorta.
W przypadku zespołu niedorozwoju lewych oddziałów dochodzi do zaburzeń krążenia wczesne stadia rozwój płodu. W przeciwieństwie do normalnego krążenia płodowego, kiedy krew z żyły głównej częściowo przechodzi przez okienko owalne do lewego serca i do krążenia ogólnoustrojowego, cała krew dostaje się do prawej komory i pień płucny. Występuje również wypływ krwi z lewego przedsionka w prawo przez otwór owalny. Dlatego przedporodowo obserwuje się przeciążenie objętościowe i rozstrzenie prawej komory (ryc. 16). Cechy hemodynamiki wewnątrzsercowej wyjaśniają również fakt, że kolorowe mapowanie przepływu ujawnia wsteczny lub dwukierunkowy przepływ krwi przez otwór owalny i wsteczny przepływ krwi w dalszej części aorty.
Ryż. 16. Hipoplazja lewej komory. Stosunek wielkości jam serca zmienia się z powodu kompensacyjnego wzrostu wielkości prawej komory.
LV i RV - lewa i prawa komora.
Przedwczesne zamknięcie otworu owalnego. W przypadku przedporodowego zamknięcia otworu owalnego rozwija się prawokomorowa niewydolność serca i dziecko zwykle rodzi się martwe. Lewe odcinki ulegają hipoplastyce, mięsień sercowy lewej komory jest znacznie przerośnięty (ryc. 17).

Ryż. 17. Przedwczesne zamknięcie otworu owalnego. Występuje umiarkowana hipoplazja lewej komory, znaczny wzrost lewego przedsionka, strzałka pokazuje otwór mitralny.
LV - lewa komora, LA - lewy przedsionek, MV - zastawka mitralna.
Wreszcie trzecia grupa wrodzonych wad serca, która według zmian hemodynamicznych w echokardiogramie okresu przedporodowego różni się od zmian w danych ultradźwięk w okresie postnatalnym. Grupa ta nie jest liczna i zostanie szczegółowo omówiona. Obejmowała następujące wrodzone wady serca: ubytek w przegrodzie międzyprzedsionkowo-komorowej, tetralogię Fallota, zespół Steidel'a, koarktację aorty.
Ubytek przegrody międzyprzedsionkowo-komorowej. Na pełna forma ubytek przegrody międzyprzedsionkowo-komorowej, wszystkie cztery komory komunikują się ze sobą. Zaburzenia hemodynamiczne są determinowane obecnością komunikatów na poziomie przedsionków i komór oraz wadliwą funkcją zastawek przedsionkowo-komorowych. Obciążenie wszystkich komór serca jest znacznie zwiększone.
Diagnostyka ultrasonograficzna ubytek w przegrodzie międzyprzedsionkowo-komorowej opiera się na anatomicznych elementach ubytku (identyfikacja pierwotnego ubytku w przegrodzie międzyprzedsionkowej; obecność wysokiego ubytku w przegrodzie międzykomorowej; przy pełnej postaci obecność szczeliny między zastawką mitralną i trójdzielną). Istnieją oznaki anomalii zastawka mitralna, które objawiają się zbieżnością płatka przedniego z przegrodą międzykomorową. Ten znak przez analogię z angiografią nazywa się objawem gęsiej szyi.
Oprócz anatomicznych elementów patologii występują zmiany związane ze zmianami hemodynamicznymi:
- powiększenie prawego przedsionka;
- zmniejszenie wymiarów lewej komory związane z obecnością przecieku tętniczo-żylnego krwi, a także z często obserwowanym ubytkiem przegrody międzyprzedsionkowo-komorowej umiarkowana hipoplazja lewa komora.
Co dzieje się przed porodem? Krew z żyły głównej górnej i dolnej z prawego przedsionka wpływa do lewego przedsionka przez otwór owalny. Dlatego u płodu nie obserwuje się wzrostu prawego przedsionka, który objawia się po urodzeniu. Występuje wzrost w jamie lewego przedsionka. Jest to pierwsza różnica w obrazach ultrasonograficznych hemodynamicznych kanału przedsionkowo-komorowego u płodu (ryc. 18).
Ryż. 18. Ubytek przegrody międzyprzedsionkowo-komorowej (strzałka).
LV - lewa komora.
Druga różnica w objawach hemodynamicznych jest zwiększona lub normalne rozmiary lewej komory w przeciwieństwie do zmniejszonej wielkości widocznej po urodzeniu.
Tetralogia Fallota. Zmiany hemodynamiczne w tetralogii Fallota wynikają ze stopnia utrudnienia wyrzutu krwi z prawej komory do krążenia płucnego oraz obecności ubytku w przegrodzie międzykomorowej. Wielkość przecieku krwi zależy od stopnia niedrożności wyrzutu krwi z prawej komory do tętnicy płucnej oraz oporu wielkie kółko krążenie.
Anatomiczne objawy patologii obejmują dekstropozycję aorty i ubytek przegrody międzykomorowej. Osobliwość przy tej patologii rozważa się wzrost średnicy aorty i zwężenie lejka tętnicy płucnej. Przerost mięśnia sercowego prawej komory z niewielkim rozszerzeniem jego jamy należy uznać za hemodynamiczną manifestację patologii.
Płód wyraźnie wizualizuje również charakterystyczne zmiany anatomiczne: szeroką aortę, umiejscowioną jako „aorta jeździecka”, ubytek w przegrodzie międzykomorowej. W przeciwieństwie do dzieci i dorosłych zwężenie tętnicy płucnej nie jest wykrywane przed porodem. Brak zwężenia podzastawkowego we wczesnym okresie noworodkowym jest również zauważany przez patologów. Odpowiada to opinii, że ten składnik patologii objawia się bardziej wiek dojrzały i wzrasta wraz z wiekiem pacjenta.
W okresie przedporodowym prawa komora, ze względu na obecność zwężenia tętnicy płucnej i ubytku w przegrodzie międzykomorowej, jest mniej zaangażowana w pracę serca, niż obserwuje się to normalnie, gdy główne obciążenie spada właśnie na prawe odcinki serca. Dlatego wielkość prawej komory jest zmniejszona w porównaniu z normą wieku ciążowego. W tym samym czasie krążenie krwi odbywa się przez zwiększone obciążenie do lewej komory. Te ostatnie w wyniku intensywnej pracy przerastają, począwszy od 22 tygodnia ciąży. Zatem przedporodowo przerost mięśnia sercowego lewej komory jest typowy dla tetrady Fallota (ryc. 19).
Ryż. 19. Tetralogia Fallota. Podwójna strzałka pokazuje ubytek przegrody międzykomorowej. Strzałki wskazują przerost mięśnia sercowego lewej komory.
LV - lewa komora, AO - aorta.
Koarktacja aorty. Głównym objawem diagnostycznym koarktacji aorty jest uwidocznienie łuku i aorty zstępującej z obecnością jej anatomicznego przewężenia. Przedporodowo ten anatomiczny znak patologii obserwuje się tylko w 30% przypadków, ponieważ koarktacja często tworzy się po urodzeniu i zamknięciu przewodu tętniczego.
Hemodynamiczne objawy wad rozwojowych u dzieci i dorosłych obejmują:
- przerost mięśnia sercowego lewej komory;
- powiększenie lewego przedsionka.
W okresie przedporodowym, w przypadku koarktacji aorty, prawa komora, która aktywnie bierze udział w ukrwieniu narządów płodu, przeciwdziała oporom przepływu przez przewód tętniczy do aorty zstępującej. W efekcie dochodzi do powiększenia jamy prawej komory i jej przerostu. (Rys. 20). Pień tętnicy płucnej jest również poszerzony. Te ultrasonograficzne objawy patologii występują w 70% przypadków.

Ryż. 20. Koarktacja aorty (a, b). Poważne zwężenie aorty typowe miejsce na obrazie trójwymiarowym (b). W badaniu wzdłuż osi długiej serca zaznaczono przerost mięśnia sercowego prawej komory.
MRV - mięsień sercowy prawej komory, IVS - przegroda międzykomorowa.
Ocenę patologii zaproponowano na podstawie wskaźnika stosunku wielkości prawej komory do wielkości lewej komory oraz stosunku średnicy tętnicy płucnej do średnicy aorty. Zwykle wskaźniki te wynoszą odpowiednio 1,1 i 1,2.
Przy wyraźnym zwężeniu aorty (zwężenie do 25% normy) obserwuje się wczesne objawy niewydolności serca u płodu, objawiające się obecnością wysięku osierdziowego, znacznym zmniejszeniem wielkości lewej komory i zmniejszeniem częstości akcji serca. wyjście.
Hipoplazja lewej komory z uszkodzeniem łuków i aorty. Rozpoznanie patologii przedporodowej zdaniem wielu autorów nie jest trudne, wszystkie objawy istotne dla rozpoznania u noworodków i dorosłych powinny być wykorzystane w badaniu prenatalnym.
Do klasyki znaki ultradźwiękowe zespół hipoplazji lewej komory obejmują:
- ostre zwężenie wstępującego łuku aorty;
- zmniejszenie rozmiaru końcoworozkurczowego lewej komory;
- zwężenie średnicy aorty;
- zwiększenie rozmiaru końcoworozkurczowego prawej komory;
- stosunek wielkości końcoworozkurczowej lewej komory do wielkości końcoworozkurczowej prawej, równy lub mniejszy niż 0,6;
- obecność poważnych zmian w zastawce mitralnej.
Zadanie diagnostyczne może być ułatwione w obecności wodobrzusza, hydroperikardium u płodu lub współistniejącej patologii pozasercowej.
Identyfikacja wszystkich zmian anatomicznych w zespole hipoplazji lewej komory nie nastręcza istotnych trudności. Jednak dostępne obserwacje wykazały, że w niektórych przypadkach jama lewej komory nieznacznie się zmniejsza, podczas gdy występuje wyraźny przerost mięśnia sercowego lewej komory. Porównanie z danymi po urodzeniu, a także z danymi z sekcji zwłok wykazało, że tak charakterystyczne zmiany w zespole hipoplazji lewej komory obserwuje się najcięższe anatomiczny kształt patologia - zespół Steidela (atrezja zastawka aorty połączona z hipoplazją dział rosnący aorta). Wskaźnik stosunku wielkości lewej komory do wielkości prawej komory w rozkurczu mieści się w granicach 0,6. Przy hipoplazji lewej komory bez uszkodzenia łuku aorty nie przekracza 0,15-0,2. W zespole Steidela, jeśli występuje mały rozmiar lewej komory, przedporodowo występuje wyraźny przerost mięśnia sercowego lewej komory do 0,7 cm (ryc. 21), w zespole hipoplazji lewej komory bez uszkodzenia łuku aorty, grubość mięśnia sercowego nie przekracza 2-3 mm.
Ryż. 21. Zespół Steidela. Przekrój czterokomorowy serca. Jama lewej komory jest zmniejszona. Występuje wyraźny przerost mięśnia sercowego lewej komory i przegrody międzykomorowej. Jamy prawej komory i prawego przedsionka są znacznie powiększone.
LV i RV - lewa i prawa komora, LA i RA - lewy i prawy przedsionek.
Tak więc podczas wieloletniej obserwacji wad serca u płodu cechy hemodynamiczne przejawy różnych nozologicznych postaci patologii. Wszystko to, przy wyraźnej manifestacji anatomicznych elementów wad serca, może pomóc w ich diagnostyce prenatalnej.
Literatura
- Mac Mahon B., Mc Keown T., Record RG Zapadalność i długość życia dzieci z wrodzonymi wadami serca // Br. Serce J. 1953. V. 15. s. 121-129
- Cabrera E., Monroy J. Systilic i rozkurczowe opóźnienie serca // Am. Serce J.1952. V. 43. N 5. S. 661.
- Zatikyan EP Cechy hemodynamiki wewnątrzsercowej u pacjentek z wrodzonymi wadami serca w czasie ciąży. diss. ... dok. Miód. Nauki. M., 1988.
- Burakovsky VI, Bokeria LA Chirurgia sercowo-naczyniowa. M.: Medycyna, 1989.
- Zatikyan EP Wzorce hemodynamiczne zmian echokardiograficznych we wrodzonych wadach serca Kardiologiya. 1990. N 8. S. 47-50.
- Zatikyan EP Wrodzone i nabyte wady serca u kobiet w ciąży. Diagnostyka funkcjonalna i ultrasonograficzna. M.: Triada-X, 2004.
- Allan L.D., Cook A.C., Huggon C. Echokardiografia płodu/Cambridge University Press, 2009.
- Kleinmann C.S., Donnerstein RL, De Vore GR. i in. Echokardiografia płodu do oceny zastoinowej niewydolności serca in utero: technika badania nieimmunologicznego obrzęku płodu // N. Engl. J. Med. 1982. V. 306. S. 568.
- Sahn DJ Sh ndrom in utero związany z obrzękiem płodu // Am. Serce J. 1982. V.104, nr 6. s. 1368-1372.
- Norberger LK, Sanders SP, Rein AJ i in. Zmiany obturacyjne lewego serca i wzrost lewej komory u płodu w połowie trymestru. Badanie podłużne // Cyrkulacja. 1995. V. 92. N 6. s. 1531-1538.
- Miedwiediew M.V. USG prenatalne. Diagnostyka różnicowa i prognoza. Moskwa: czas rzeczywisty, 2009
- Nanda N., Gramiak R. Echokardiografia kliniczna. Louis, 1975.
- Zatikyan EP Ubytek przegrody międzyprzedsionkowo-komorowej w okresie prenatalnym // Międzynarodowe Towarzystwo Płód jako pacjent IX Międzynarodowy Kongres 1993. S. 41. Tokio.
- Zatikyan EP ubytek przegrody międzyprzedsionkowo-komorowej okres prenatalny// Diagnostyka ultradźwiękowa w położnictwie, ginekologii i pediatrii. 1993. Nr 3. C. 40-45.
- Ohba T., Matsui K., Nakamura K. i in. Tetralogia Fallota z brakiem zastawki pnia płucnego wykryta w badaniu echokardiograficznym płodu // Int. Ginekol. uporczywy 1990. V. 32. N 1. s. 71-74.
- Zatikyan EP Kardiologia płodu. M.: Triada-X, 2009.
- Allan LD, Chita SK, Anderson RH i in. Koarktacja aorty w życiu prenatalnym: badanie echokardiograficzne, anatomiczne i czynnościowe // Br. Serce J. 1988. V. 59. S. 356.
- Zatikyan EP Echokardiograficzna ocena nasilenia zmian anatomicznych i hemodynamicznych w zespole hipoplazji lewego serca: dynamiczny nadzór od płodu do noworodka // Diagnostyka ultradźwiękowa. 2000. N 3. S. 29-36.
- grupa chorób połączona obecnością wad anatomicznych serca, jego aparatu zastawkowego lub naczyń krwionośnych powstałych podczas okres prenatalny prowadząc do zmian hemodynamiki wewnątrzsercowej i ogólnoustrojowej. Manifestacje wrodzonej wady serca zależą od jej rodzaju; do najbardziej charakterystyczne objawy obejmują bladość lub sinicę skóry, szmery w sercu, opóźnienie rozwój fizyczny objawy niewydolności oddechowej i serca. Jeśli podejrzewa się wrodzoną wadę serca, wykonuje się EKG, FCG, radiografię, echokardiografię, cewnikowanie serca i aortografię, kardiografię, MRI serca itp. Najczęściej z wrodzonymi wadami serca uciekają się do kardiochirurgii - chirurgicznej korekty zidentyfikowanego anomalia.
Powikłaniami wrodzonych wad serca mogą być bakteryjne zapalenie wsierdzia, policytemia, zakrzepica naczynia obwodowe i choroba zakrzepowo-zatorowa naczyń mózgowych, zastoinowe zapalenie płuc, omdlenia, napady duszności i sinicy, dusznica bolesna lub zawał mięśnia sercowego.
Diagnostyka wrodzonych wad serca
Wykrywanie wrodzonych wad serca odbywa się za pomocą kompleksowe badanie. Podczas badania dziecka odnotowuje się kolor skóry: obecność lub brak sinicy, jej charakter (obwodowy, uogólniony). Osłuchiwanie serca często ujawnia zmianę (osłabienie, wzmocnienie lub rozszczepienie) tonów serca, obecność szumów itp. Uzupełnieniem jest badanie fizykalne pod kątem podejrzenia wrodzonej wady serca diagnostyka instrumentalna- elektrokardiografia (EKG), fonokardiografia (FCG), radiografia klatki piersiowej, echokardiografia (EchoCG).
EKG ujawnia przerost różne działy kiery, odchylenie patologiczne EOS, obecność arytmii i zaburzeń przewodzenia, które w połączeniu z danymi uzyskanymi innymi metodami badanie kliniczne pozwala ocenić ciężkość wrodzonej wady serca. Za pomocą całodobowego monitorowania EKG metodą Holtera wykrywane są utajone zaburzenia rytmu i przewodzenia. Za pomocą FCG dokładniej i szczegółowo ocenia się charakter, czas trwania i lokalizację tonów serca i szmerów. Dane RTG klatki piersiowej uzupełniają dotychczasowe metody o ocenę stanu krążenia płucnego, umiejscowienia, kształtu i wielkości serca, zmian w innych narządach (płuca, opłucna, kręgosłup). Na echokardiografia ubytki anatomiczne przegród i zastawek serca, uwidacznia się położenie głównych naczyń, ocenia się kurczliwość mięśnia sercowego.
Przy złożonych wrodzonych wadach serca, a także współistniejącym nadciśnieniu płucnym, w celu dokładnego rozpoznania anatomicznego i hemodynamicznego konieczne staje się wykonanie sondowania jam serca oraz angiokardiografii.
Leczenie wrodzonych wad serca
Bardzo trudny problem w kardiologii dziecięcej zajmuje się chirurgicznym leczeniem wrodzonych wad serca u dzieci do pierwszego roku życia. Większość operacji we wczesnym dzieciństwie wykonuje się z powodu siniczych wrodzonych wad serca. W przypadku braku objawów niewydolności serca u noworodka, umiarkowanej sinicy, operację można odłożyć. Dzieci z wrodzonymi wadami serca są pod opieką kardiologa i kardiochirurga.
Specyficzne leczenie w każdym przypadku zależy od rodzaju i ciężkości wrodzonej wady serca. Operacje o godz wady wrodzone przegrody serca (VSD, ASD) mogą obejmować plastykę lub szycie przegrody, zamknięcie ubytku wewnątrznaczyniowego na zdjęciu rentgenowskim. W przypadku wystąpienia ciężkiej hipoksemii u dzieci z wrodzonymi wadami serca pierwszym etapem jest interwencja paliatywna, która polega na nałożeniu różnego rodzaju zespolenia międzysystemowe. Ta taktyka poprawia dotlenienie krwi, zmniejsza ryzyko powikłań, pozwala radykalna korekta w więcej korzystne warunki. Przy ubytkach aorty wykonuje się resekcję lub balonowe poszerzenie koarktacji aorty, plastykę zwężenia aorty itp. W przypadku wykonywania PDA jest ona podwiązywana. Leczenie zwężenia płuc polega na wykonaniu otwartej lub wewnątrznaczyniowej walwuloplastyki itp.
Anatomicznie złożone wrodzone wady serca, w których operacja radykalna nie jest możliwe, wymagają korekcji hemodynamicznej, czyli rozdzielenia przepływów krwi tętniczej i żylnej bez usunięcia wady anatomicznej. W takich przypadkach można wykonać operacje Fontana, Senninga, Mustarda itp. Poważne wady, które nie podlegają naprawie leczenie chirurgiczne wymaga przeszczepu serca.
Leczenie zachowawcze wrodzonych wad serca może obejmować leczenie objawowe duszność – napady sinicze, ostra niewydolność lewokomorowa (astma sercowa, obrzęk płuc), przewlekła niewydolność serca, niedokrwienie mięśnia sercowego, zaburzenia rytmu serca.
Predykcja i profilaktyka wrodzonych wad serca
W strukturze umieralności noworodków pierwsze miejsce zajmują wrodzone wady serca. Bez zapewnienia kwalifikowanej kardiochirurgii w pierwszym roku życia umiera 50-75% dzieci. W okresie wyrównawczym (2-3 lata) śmiertelność spada do 5%. Wczesne wykrycie i korekcja wrodzonej wady serca może znacząco poprawić rokowanie.
Profilaktyka wrodzonych wad serca wymaga starannego planowania ciąży, wykluczenia wpływu niekorzystnych czynników na płód, poradnictwa medyczno-genetycznego oraz pracy wyjaśniającej wśród kobiet zagrożonych urodzeniem dzieci z wadami serca, poruszającej problematykę prenatalnej diagnostyki wady (USG, biopsja kosmówki, amniopunkcja) oraz wskazania do aborcji. Wymagane jest prowadzenie ciąży u kobiet z wrodzoną wadą serca wzmożona uwaga przez położnika-ginekologa i kardiologa.
Echokardiografia (USG serca) to metoda badania narządu, wykazująca istniejące pogorszenia i odchylenia. Ultrasonografia jest całkowicie bezpieczną i nieskomplikowaną procedurą, która wykrywa choroby takie jak nadciśnienie płucne, wady wrodzone u dzieci, wady zastawki mitralnej, wypadanie i inne zaburzenia.
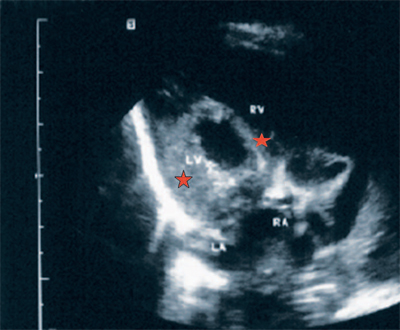
Zgodnie z budową serce można podzielić na cztery sekcje (komory): lewy i prawy przedsionek oraz lewą i prawą komorę. Przegroda międzyprzedsionkowa oddziela oba przedsionki, przegroda międzykomorowa oddziela komory. Celem tych przegród jest zapobieganie mieszaniu się grup krwi. Zastawka trójdzielna łączy prawy przedsionek i prawą komorę. Przenoszą krew z żył do płuc. Lewy przedsionek i lewa komora są połączone zastawką mitralną. Z ich pomocą krew tętnicza rozprzestrzeniają się po całym ciele i nie pozwalają krwi wrócić z powrotem do serca.
Ludzkie serce podzielone jest na cztery komory: lewy i prawy przedsionek oraz lewą i prawą komorę, oddzielone od siebie. Ta separacja jest konieczna, aby krew żylna i tętnicza nie mieszały się ze sobą.
Po co jest badanie?
Echokardiografia (USG serca) jest uważana za prostą procedurę diagnostyczną, która pomaga wykryć niektóre choroby, zanim wystąpią ich objawy. Zwykle echokardiografia jest przepisywana osobom cierpiącym na duszność, zawroty głowy, letarg, omdlenia, występowanie ataków tachykardii, zaburzenia zakłócające czynność serca i ból narządu.
Jeśli zostanie wykryty szmer serca, istnieje podejrzenie chorób szkodliwych dla układu sercowo-naczyniowego (np. postać przewlekła, obecny choroba hipertoniczna, a elektrokardiografia wskazuje na zaburzenia czynności serca, wówczas konieczna jest wizyta na badanie. Jest również przepisywany dzieciom w celu potwierdzenia choroby serca przy urodzeniu.

Większość najnowsze urządzenia Ultrasonograf przeprowadza nie tylko badanie ultrasonograficzne układu sercowo-naczyniowego, ale jest również w stanie wykonać Dopplerografię, która polega na śledzeniu ruchu krwi w komorach serca. Pomaga obserwować funkcjonowanie narządu i identyfikować nieprawidłowości w rozwoju zastawek.
Normy echokardiografii serca
Echokardiografia ujawnia szereg nieprawidłowości w czynności mięśnia sercowego. Tylko specjalista może przeanalizować i wyciągnąć wnioski. Następujące parametry są normalne dla echokardiografii:
- średnica aorty - do 3,7 cm;
- otwarcie płatków zastawki aortalnej - 1,5 cm lub więcej;
- rozmiar lewego przedsionka - do 4 cm;
- końcowa wielkość rozkurczowa lewej komory - do 5,5 cm;
- końcowy rozmiar skurczowy lewej komory - do 4,1 cm;
- grubość przegrody międzykomorowej - do 1,1 cm;
- grubość tylnej ściany lewej komory - do 1,1 cm;
- frakcja wyrzutowa - nie mniej niż 60%;
- frakcja skracająca - 30-40%;
- powierzchnia otwarcia zastawki mitralnej - 4 cm2;
- wielkość jamy prawej komory wynosi do 3 cm.
Przeprowadzając echokardiografię, lekarz bada wielkość komór, grubość ścian, kontury i aktywność zastawek, aktywność mięśnia sercowego (warstwa mięśniowa). Wskazuje na to pogorszenie niektórych wskaźników różne naruszenia układu sercowo-naczyniowego.
 Na USG serca (echokardiografia) lekarz może zobaczyć budowę narządu, grubość i funkcjonalność ścian komór, prześledzić położenie i wielkość zastawek. Wszystkie te dane są bardzo pouczające przy stawianiu diagnozy.
Na USG serca (echokardiografia) lekarz może zobaczyć budowę narządu, grubość i funkcjonalność ścian komór, prześledzić położenie i wielkość zastawek. Wszystkie te dane są bardzo pouczające przy stawianiu diagnozy. Nadciśnienie płucne w USG
Nadciśnienie płucne- narastający wzrost ciśnienia w tętnicy płucnej. Rozróżnij nadciśnienie wrodzone i nabyte. Echokardiografia dostarcza maksymalnej ilości informacji do określenia ciśnienia tętniczego w celu postawienia diagnozy nadciśnienia płucnego. Wskaźniki występujące w trybie M, takie jak zahamowanie otwarcia zastawki tętniczej, jej zamknięcie podczas skurczu oraz wydłużenie czasu wyrzutu prawej komory w stosunku do całkowitego czasu wyrzutu, wskazują na nadciśnienie płucne.
Dwuwymiarowe USG może wykazać przerost prawej komory. Jeśli jego ściana ma więcej niż 10 mm, wynika z tego wniosek o nadmiernym przeroście, który obserwuje się w przewlekłym serce płucne. Pojęcie normy (brak nadciśnienia tętniczego) mieści się w wartości poniżej 4 mm, podczas gdy ostre nadciśnienie płucne daje 6-8 mm. grubość ściany. badanie 2D w nadciśnieniu ujawnia się również elastyczność przegrody międzykomorowej. Ciężkie nadciśnienie płucne powoduje paradoksalny ruch skurczowy, co w połączeniu ze zmniejszonym przepływem płucnym skutkuje gorszą relaksacją izometryczną lewej komory.
Dodatkowe objawy nadciśnienia tętniczego:
- przetaczanie krwi od prawej do lewej wzdłuż otwartego przewodu tętniczego;
- przetaczanie krwi od prawej do lewej przez okienko owalne;
- tętnica płucna z ciśnieniem większym niż 40 mm. rt. Art., ponad 50% całkowitego ciśnienia.
Wrodzone wady serca w badaniu u dzieci
Wrodzone wady serca to nieprawidłowości w budowie anatomicznej narządu, które są patologiami wewnątrzmacicznymi. Często ta patologia jest spowodowana przez negatywne wpływy do zarodka w łonie matki. Istnieje kilka odmian tej choroby.
 Choroba serca jest anomalią, która rozwija się w macicy. Najczęściej jest to związane z predyspozycją genetyczną lub ujemne wpływ zewnętrzny na płód
Choroba serca jest anomalią, która rozwija się w macicy. Najczęściej jest to związane z predyspozycją genetyczną lub ujemne wpływ zewnętrzny na płód Otwarty przewód tętniczy- kanał, który ustanawia połączenie między tętnicą płucną a aortą. Podczas rozwoju wewnątrzmacicznego aktywnie zaopatruje płód w tlen, nie wykorzystując do tego celu płuc. Zarasta 2-8 tygodni po urodzeniu. Jeśli tak się nie stanie, uważa się to za wadę. wrodzona patologia dzieci mogą nie mieć żadnych objawów, ale czasami choroba objawia się opóźnieniem wzrostu, ciemnieniem skóry, częstym zapaleniem płuc. Podczas badania ultrasonograficznego można zauważyć wzrost ściany przedsionka i komory serca dotkniętego wadą, a dopplerografia wykaże, czy dochodzi do wypływu krwi z aorty do tętnicy płucnej, co jest również wskaźnikiem patologia.
Ubytek przegrody międzykomorowej- patologia, gdy błona ma wrodzoną szczelinę między prawą i lewą komorą. Z lewej komory wysokie ciśnienie krew przesuwa się w prawo, w którym ciśnienie jest niskie. Wrodzona wada rozwojowa charakteryzuje się takimi objawami: opóźnienia rozwojowe, częste zapalenie płuc. Podczas badania można zauważyć wrodzony wzrost jamy serca, wzrost grubości ściany. Dopplerografia określa przepływ krwi z lewej komory do prawej.
Ubytek przegrody międzyprzedsionkowej- ściana znajdująca się między przedsionkami ma szczelinę. Diagnostyka ultrasonograficzna pozwala zobaczyć pogrubione przedsionki, czasem widoczne i bezpośrednio wrodzoną szczelinę.
Wady zastawki mitralnej w diagnostyce
zwężenie zastawki mitralnej- wada ze zmniejszeniem szczeliny zlokalizowanej między lewym przedsionkiem a lewą komorą. Manifestacje patologii: zawroty głowy, duszność, szybkie bicie serca, ból W skrzyni. Choroba powoduje pogrubienie płatków zastawki, ścian lewego przedsionka i prawej komory.
Wypadanie płatka zastawki mitralnej- wada z rozciągnięciem szczeliny w przestrzeni lewego przedsionka i lewej komory, a także wypadanie - jest to słabe uciskanie płatków zastawki mitralnej w czasie skurczu. Wypadanie płatka zastawki mitralnej występuje wrodzona i różni się w 1. i 2. stadium wypadania. Często takie wypadanie nie jest uważane za chorobę i nie wymaga leczenia. Zapalenie wsierdzia i reumatyzm mogą powodować wypadanie. Jednak wypadnięcie nie objawia się przez długi czas. Objawy wypadania zastawki mitralnej: duszność, letarg, ból od pracy fizycznej.
Echokardiografia u pacjenta z wypadnięciem zastawki mitralnej ujawnia zwiększenie objętości ścian lewej komory i przedsionka, częściowe uciśnięcie płatków zastawki mitralnej w skurczu. Zastosowanie USG Dopplera pozwala określić stopień zaawansowania wypadania.
Inne choroby serca na USG
zawał mięśnia sercowego- zaburzenie ukrwienia, które prowadzi do wygaśnięcia aktywności jednej z jego części. USG serca pacjenta który miał zawał serca mięśnia sercowego, wykrywa pogorszenie kompresji jednego z odcinków narządu.
Wysiękowe zapalenie osierdzia- gromadzenie się wilgoci w osierdziu (powłoce narządu). Zapalenie osierdzia objawia się w badaniu ultrasonograficznym wykryciem wilgoci nagromadzonej w worku sercowym.
Zapalenie mięśnia sercowego- rodzaje chorób charakteryzujących proces zapalny mięsień sercowy. Oznaki naruszenia echokardiografii: wzrost komór narządu, zmniejszenie funkcji skurczowej, zmniejszenie wielkości wyrzutu lewej komory (mniej niż 50%).
Infekcyjne zapalenie wsierdzia- wnikanie infekcji powoduje zapalenie wsierdzia. Pęknięcia i rozgałęzienia na zaworach - oznaki infekcyjne zapalenie wsierdzia w diagnostyce USG.

