Odzyskiwanie metabolizmu tłuszczów. Naruszenie metabolizmu tłuszczów, leczenie, objawy, środki ludowe
Zaburzenia metabolizmu lipidów mogą wystąpić w wyniku naruszeń: 1) wchłaniania tłuszczu w jelicie; 2) przejście tłuszczu z krwi do tkanki; 3) odkładanie się tłuszczu: 4) śródmiąższowe metabolizm tłuszczów.
§ 198 Zaburzenia wchłaniania tłuszczu
Aby wchłonąć tłuszcz pokarmowy z jelita, musi być zemulgowany, rozłożony na glicerol i kwas tłuszczowy oraz tworzenie związków kompleksowych z kwasami żółciowymi - choleinianami. W związku z tym ustanie wydzielania żółci w dwunastnica lub zmniejszenie jego wydzielania natychmiast odbija się na trawieniu tłuszczów. Zatkanie przewodu żółciowego, zapalenie pęcherzyka żółciowego (zapalenie pęcherzyka żółciowego) i niektóre choroby wątroby związane z zaburzeniami procesu wydzielania żółci powodują, że niezemulgowane tłuszcze przechodzą przez przewód pokarmowy, odsłaniając się tylko w niewielkim stopniu. w dużej mierze hydroliza. Jeśli hydroliza tłuszczów w diecie jest w tym przypadku przeprowadzana w wystarczającym stopniu pod działaniem lipaz soków trzustkowych i jelitowych, to powstałe kwasy tłuszczowe nadal nie są wchłaniane. To samo dzieje się ze zmniejszeniem lub całkowitym zaprzestaniem wydzielania enzymów trzustkowych, ze zmniejszeniem funkcji nabłonka jelitowego i znacznym zwiększona perystaltyka jelito cienkie kiedy tłuszcz nie ma czasu na wchłonięcie. Tego rodzaju zaburzenia wchłaniania tłuszczu obserwuje się w zapaleniu jelit, hipowitaminozie A i B, ze względu na naruszenie tworzenia się enzymów biorących udział w resyntezie trójglicerydów w nabłonku jelitowym.
Wydzielanie tłuszczu odbywa się głównie przez jelita, w mniejszym stopniu przez łojowe i gruczoły potowe. W moczu znajdują się tylko śladowe ilości tłuszczu. Przy zaburzonym wchłanianiu tłuszczu kał zawiera dużo niestrawionego tłuszczu i wyższych kwasów tłuszczowych oraz ma charakterystyczny szaro-biały kolor - stolce tłuszczowe. Wydalanie tłuszczu z moczem - lipuria - może wystąpić po spożyciu bardzo dużej ilości tłuszczu z pokarmem, ze złamaniami kości kanalikowych, któremu towarzyszy zmiażdżenie szpik kostny, uraz dużych obszarów tkanki tłuszczowej, z nerczycą lipidową.
Nadmierne wydzielanie tłuszczu gruczoły łojowe- łojotok - występuje w niektórych chorobach skóry - trądzik, egzema, beri-beri itp.
Konsekwencje złego wchłaniania tłuszczu- choć tłuszcze i lipidy są łatwo syntetyzowane w organizmie z produktów pośrednich metabolizmu węglowodanów, to całkowite wykluczenie tłuszczów z pożywienia jest niedopuszczalne. W przypadku tłuszczów do organizmu wprowadzane są niezbędne witaminy rozpuszczalne w tłuszczach (A, D, E, K), dlatego przy niewystarczającym wprowadzeniu tłuszczów z pożywieniem u ludzi i zwierząt może rozwinąć się hipowitaminoza. Ponadto w składzie naturalnych tłuszczów zawsze znajduje się niewielka ilość niezbędnych nienasyconych wyższych kwasów tłuszczowych (np. linolowy-C18H32O2 i linolenowy-C18H30O2), których nie można syntetyzować w organizmie z inne kwasy tłuszczowe. W przypadku braku ich w pożywieniu zwierzęta w eksperymencie rozwijają się choroby przewlekłe skóra (w postaci ognisk martwiczych). Widocznie całkowita nieobecność nienasycone wyższe kwasy tłuszczowe w żywności człowieka również mogą być przyczyną mniej lub bardziej poważne zaburzenia Wymieniać się.
§ 199. Naruszenie przejścia tłuszczu z krwi do tkanki
Tłuszcz obojętny z jelit krąży we krwi w postaci chylomikronów (składających się z trójglicerydów, estrów cholesterolu, fosfolipidów i β-lipoprotein) i α-lipoprotein. Normalnie zawartość tłuszczów obojętnych we krwi wynosi 1-2 g/l.
Przy zwiększonym spożyciu tłuszczu z pożywienia obserwuje się przejściowy przejściowy wzrost zawartości chylomikronów we krwi - hiperlipemię ( hiperlipemia przewodu pokarmowego). Hiperlipemia może być wynikiem zwiększonej mobilizacji tłuszczu z magazynu - hiperlipemia transportowa(Rys. 35).
Wiele hormonów przyczynia się do mobilizacji tłuszczu ze złogów tłuszczu, płuc i szpiku kostnego. Na przykład podczas głodu uwalnianie tłuszczu z jego składu następuje w wyniku połączonego działania hormonu wzrostu przysadki mózgowej, glukagonu trzustkowego i adrenaliny. Działanie tych hormonów na tkankę tłuszczową realizowane jest poprzez układ cyklazy adenylowej – tAMP. Ta ostatnia zwiększa aktywność lipazy trójglicerydowej, która prowadzi lipolizę w tkankach.
Mobilizacja tłuszczu z płuc, prowadząca do hiperlipemii, występuje głównie w przypadku długotrwałej hiperwentylacji płuc, na przykład u zawodowych śpiewaków.
Hiperlipemia retencyjna(retentio - opóźnienie) - wynik opóźnienia w przechodzeniu obojętnych tłuszczów z krwi do tkanek, występuje głównie ze spadkiem zawartości albuminy we krwi i czynnika oświecenia (AF), specyficznej lipazy lipoproteinowej. Pod działaniem FP triglicerydy związane z białkami ulegają rozszczepieniu i w ten sposób następuje „oświecenie” surowicy lipemicznej. Powstałe wolne kwasy tłuszczowe są wiązane przez albuminę (1 cząsteczka albuminy wiąże 6-7 cząsteczek kwasów tłuszczowych), co przyczynia się do przejścia tłuszczu do komórek. Dlatego brak albuminy we krwi (na przykład podczas głodu, choroby nerek - nerczyca) prowadzi do hiperlipemii, a także niewystarczającej zawartości FP i heparyny. Na przykład w miażdżycy hiperlipemia zależy od spadku aktywności heparyny i niskiej aktywności lipazy lipoproteinowej (LP). W cukrzycy zmniejszenie AF we krwi zależy od braku lipokainy.
§ 200. Nadmierne nagromadzenie tłuszczu w tkance tłuszczowej
Otyłość jest wynikiem rozregulowania wnikania tłuszczu do tkanki tłuszczowej, jego powstawania i wykorzystania jako źródła energii.
Jedną z istotnych przyczyn otyłości jest nadmierne (w stosunku do kosztów energii) przyjmowanie pokarmu związane ze zwiększonym apetytem. To ostatnie wynika w szczególności ze zwiększonej pobudliwości ośrodka żywieniowego formacje nerwowe region podwzgórza. Doświadczalnie ustalono, że podrażnienie jąder brzuszno-bocznych podwzgórza i zniszczenie jąder brzuszno-przyśrodkowych powoduje brak sytości, wzmożony apetyt, hiperfagię, a następnie odkładanie się tłuszczu (tzw. otyłość podwzgórzowa).
Klinicznym analogiem tego rodzaju otyłości jest otyłość międzymózgowa, która rozwija się w wyniku infekcyjnego i toksycznego uszkodzenia formacji nerwowych w mózgu śródmiąższowym, a także guzów w tym obszarze.
Zmniejszenie uwalniania tłuszczu z jego składu następuje, gdy funkcja jest stłumiona. Tarczyca oraz przysadka mózgowa, której hormony (tyroksyna, hormon wzrostu, TSH) aktywują mobilizację tłuszczu i jego późniejsze utlenianie. Zwiększona produkcja przysadkowego ACTH, glikokortykosteroidów nadnerczowych oraz insuliny przyczynia się do odkładania tłuszczu i jego powstawania z węglowodanów. Zmniejszenie funkcji gonad prowadzi do nadmiernego odkładania się tłuszczu, jeśli towarzyszy mu naruszenie aktywności ośrodków podwzgórza (patrz §§ 337, 338).
§ 201. Tłuszczowa infiltracja wątroby
Jeśli tłuszcz doprowadzony przez krew do komórek nie zostanie w nich poddany rozszczepieniu i utlenianiu, nie jest wydalany i długi czas pozostaje w celach naciek tłuszczowy(impregnacja). Jego połączenie z naruszeniem struktury protoplazmatycznej nazywa się zwyrodnieniem tłuszczowym.
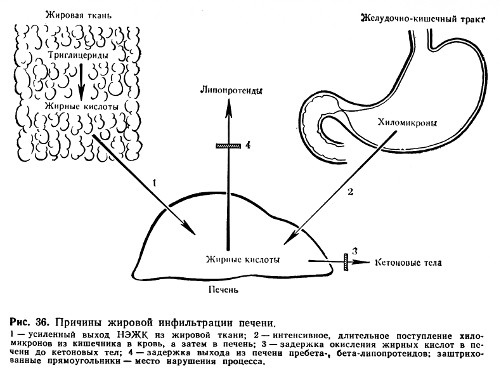
Częstą przyczyną nacieków tłuszczowych i dystrofii jest zahamowanie aktywności enzymów hydrolitycznych i oksydacyjnych metabolizmu tłuszczów (ryc. 36), co można zaobserwować w przypadku zatrucia fosforem, arsenem, chloroformem, infekcje wirusowe, beri-beri (alkoholizm).
Bardzo ważne w patogenezie nacieku tłuszczowego wątroby podaje się naruszenie tworzenia fosfolipidów. Ich wystarczająca zawartość w wątrobie zapewnia dobre rozproszenie tłuszczu, a tym samym jego uwolnienie z komórki. W cząsteczce fosfolipidu katalizuje utlenianie kwasów tłuszczowych. Niedostateczne tworzenie fosfolipidów występuje, gdy w organizmie występuje niedobór choliny, strukturalnej części głównego fosfolipidu wątroby - lecytyny. Z kolei synteza choliny związana jest z grupami metylowymi, których donorem jest aminokwas metionina. Dlatego niewystarczające wprowadzenie do organizmu choliny z diety lub jej niedostateczne wytwarzanie z powodu braku metioniny może prowadzić do stłuszczenia wątroby. Metionina, a także białko kazeinowe, w skład którego wchodzi duża liczba metionina, działa lipotropowo, czyli pomaga usunąć nadmiar tłuszczu z wątroby. Tę samą właściwość ma endogenny czynnik lipotropowy - lipokaina (powstająca w nabłonku małych przewodów trzustki). Brak lipokainy w cukrzycy przyczynia się do stłuszczenia wątroby.
§ 202. Naruszenie pośredniego metabolizmu tłuszczu
Względnie stabilnymi produktami metabolizmu pośredniego wyższych kwasów tłuszczowych są kwasy acetonowy, acetooctowy i beta-hydroksymasłowy, tzw. ciała ketonowe lub acetonowe, powstające głównie w wątrobie i utleniane do CO 2 i H 2 O w innych tkankach i narządach ( mięśnie, płuca, nerki itp.). W niektórych procesach patologicznych i chorobach (cukrzyca, głód - całkowite lub wyłącznie węglowodanowe, długotrwałe infekcje z wysoka temperatura, niedotlenienie, choroby miąższu wątroby itp.), zawartość ciał acetonowych we krwi może gwałtownie wzrosnąć (zwykle ich zawartość nie przekracza 0,02-0,04 g / l) (2-4 mg%). Acetonemia prowadzi do pojawienia się w moczu ciał ketonowych i acetonowych - aceturii. Aceton jest wydalany nie tylko przez nerki, ale także przez płuca z wydychanymi gazami i potem. Pacjent pachnie jak aceton.
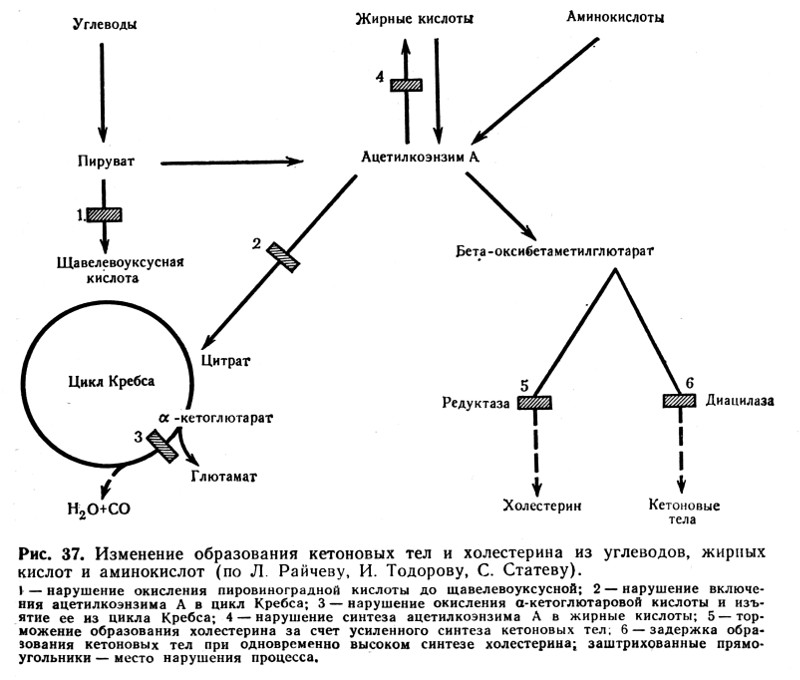
Mechanizmy prowadzące do wzrostu ciała ketonowe we krwi (ketoza) są dość złożone.
- Jedną z głównych przyczyn rozwoju ketozy jest niedobór węglowodanów (np. w cukrzycy, głodzie), co prowadzi do wyczerpania wątroby w glikogen i zwiększonego spożycia tłuszczu, gdzie kwasy tłuszczowe są utleniane do kwas acetooctowy. Sprzyja temu również niewystarczająca resynteza wyższych kwasów tłuszczowych z ciał ketonowych oraz naruszenie ich utleniania w cyklu trójkarboksylowym (cytrynowym). Resynteza wymaga energii glikolizy. Niewystarczające utlenienie ciał ketonowych wiąże się również z niedoborem związków powstających podczas pośredniego metabolizmu węglowodanów (kwasów pirogronowego i szczawiooctowego) będących substratami cyklu kwasów trikarboksylowych (ryc. 37).
- Ważnym ogniwem patogenetycznym w rozwoju ketozy w cukrzycy jest równoczesny niedobór lipokainy i insuliny.
- W przypadku uszkodzenia wątroby spowodowanego przez czynniki zakaźne toksyny upośledzona jest funkcja tworzenia glikogenu wątroby, co przyczynia się do przejścia kwasów tłuszczowych do wątroby. Tutaj tworzenie ciał ketonowych w dużej mierze przeważa nad ich utlenianiem. Rezultatem jest ketoza i stłuszczenie wątroby.
§ 203. Naruszenie metabolizmu fosfolipidów
Zaburzenia metabolizmu fosfolipidów (lecytyny, kefaliny) są ściśle związane z metabolizmem tłuszczów. Tak więc w przypadku lipemii wzrasta poziom lecytyny we krwi.
Znane są niektóre dziedziczne stany patologiczne związane z nadmiernym odkładaniem się fosfolipidów w tkankach. Na przykład w chorobie Gauchera cerebrozydy odkładają się w komórkach makrofagów śledziony, wątroby, węzły chłonne i szpik kostny. Z chorobą Niemanna-Picka w komórkach różne ciała obserwuje się odkładanie fosfatydu sfingomieliny. Amavrotic (z greckiego amauros - ciemny, ślepy) rodzinny idiotyzm jest wynikiem odkładania się lipidów w komórki nerwowe, któremu towarzyszy zanik nerwów wzrokowych i otępienie.
§ 204. Zaburzenia metabolizmu cholesterolu. Miażdżyca
Zaburzenia metabolizmu cholesterolu leżą u podstaw rozwoju miażdżycy, kamica żółciowa, nerczyca lipoidowa, związane z wiekiem zmętnienie rogówki, ksantomatoza skóry, kości i inne choroby.
Rosyjscy patofizjolodzy N. P. Anichkov i S. S. Khalatov odegrali ważną rolę w badaniu zaburzeń metabolizmu cholesterolu. W latach 1911-1912. stworzyli eksperymentalny model miażdżycy, karmiąc zwierzęta cholesterolem. Wprawdzie w patogenezie miażdżycy u ludzi znaczenie cholesterolu egzogennego (pokarmowego) nie jest tak istotne, ale fakt, że metabolizm cholesterolu jest zaburzony, nie budzi wątpliwości.
W warunkach fizjologicznych zawartość cholesterolu we krwi osoby dorosłej wynosi około 1,8-2,3 g/l. Po spożyciu pokarmów bogatych w cholesterol może wystąpić pewien wzrost poziomu cholesterolu we krwi ( żółtko mózg, wątroba, masło itp.), ale ta hipercholesterolemia pokarmowa u ludzi szybko mija, ponieważ przy nadmiarze cholesterolu z komórki tuczne heparyna jest uwalniana do krwi, aktywując lipazę lipoproteinową, tak zwany „czynnik oświecenia” (AF). Ten ostatni przekształca wielkocząsteczkowe lipidy o niskiej gęstości w drobno zdyspergowane, łatwo usuwane z krwi.
Zmiany w metabolizmie cholesterolu mogą być wynikiem upośledzonej syntezy cholesterolu, prowadzącej do endogennej hipercholesterolemii. Synteza cholesterolu jest regulowana przede wszystkim przez jego przyjmowanie z jelita: niewielkie spożycie aktywuje syntezę cholesterolu. Oprócz kwasu acetooctowego jako materiał wyjściowy do syntezy cholesterolu służą aminokwasy walina i leucyna, kwasy tłuszczowe, węglowodany, które podczas metabolizmu pośredniego są przekształcane w acetylokoenzym A.
Ważnym czynnikiem w metabolizmie cholesterolu jest aktywność enzymów tkankowych, które zapewniają rozkład lipidów. Udowodniono więc, że stany patologiczne predysponujące do miażdżycy (cukrzyca, stres, niedotlenienie), aktywność lipolityczna ściany aorty jest znacznie zmniejszona, a zawartość w niej cholesterolu gwałtownie wzrasta. Ściana aorty zdrowych ludzi zawiera 5-50 mg cholesterolu, w aorcie miażdżycowej - 240 mg, z ciężkie formy zawartość cholesterolu w miażdżycy w aorcie może osiągnąć 500-1000 mg.
Przyczyną hipercholesterolemii może być również zmiana stanu fizykochemicznego białek krwi, przez co powstaje silniejsze wiązanie między cholesterolem a β-lipoproteinami i utrudnione jest uwalnianie z kompleksu cholesterolowego, lub odwrotnie, następuje rozerwanie kompleksu β-białkowego i zmniejsza się dyspersja miceli cholesterolu. W obu przypadkach cholesterol jest zatrzymywany we krwi.
Z naruszeniem metabolizmu cholesterolu ważna jest utrata funkcji tarczycy, gruczołów płciowych i nadnerczy. To, które ogniwa metabolizmu cholesterolu są zmieniane przez każdy z tych hormonów, to bardzo skomplikowane pytanie. Mogą zmieniać szybkość transferu cholesterolu do iz komórki, wpływać na rozkład jego frakcji między osoczem krwi a płynem śródmiąższowym oraz procesy syntezy i rozkładu cholesterolu.
Najważniejszym przejawem upośledzenia metabolizmu cholesterolu w organizmie człowieka jest miażdżyca.
Lipidy- niejednorodny skład chemiczny materia organiczna, nierozpuszczalny w wodzie, ale rozpuszczalny w rozpuszczalnikach niepolarnych.
Typowymi postaciami patologii metabolizmu lipidów są otyłość, niedożywienie, lipodystrofia, lipidoza i dyslipoproteinemia.
Otyłość
Otyłość- nadmierna akumulacja lipidy w organizmie w postaci trójglicerydów.
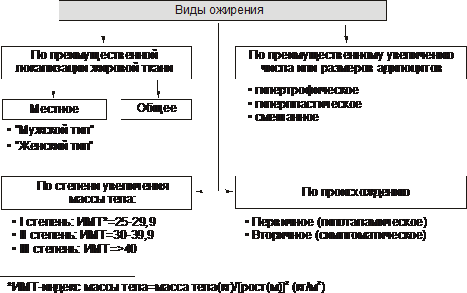
RODZAJE OTYŁOŚCI
W zależności od stopnia przybrania na wadze Istnieją trzy stopnie otyłości.
Do oszacowania optymalnej masy ciała stosuje się różne wzory.
♦ Najprostszy jest indeks Broca: 100 jest odejmowane od tempa wzrostu (w cm).
♦ Wskaźnik masy ciała (BMI) jest również obliczany według następującego wzoru:
W zależności od wartości wskaźnika masy ciała mówi się o normalnej lub nadwadze 3 stopnie (tab. 10-1).
Zgodnie z dominującą lokalizacją tkanki tłuszczowej Występuje otyłość ogólna (jednorodna) i miejscowa (lokalna lipohipertrofia). Istnieją dwa rodzaje miejscowej otyłości.
♦ typ żeński(gynoid) - nadmiar tłuszczu podskórnego głównie w udach i pośladkach.
Tabela 10-1. Stopnie otyłości
 ♦ męski typ(android lub brzuch) - nagromadzenie tłuszczu głównie w jamie brzusznej.
♦ męski typ(android lub brzuch) - nagromadzenie tłuszczu głównie w jamie brzusznej.
Według genezy rozróżnić otyłość pierwotną i jej formy wtórne.
„Otyłość pierwotna (podwzgórze) jest niezależną chorobą pochodzenia neuroendokrynnego, spowodowaną zaburzeniem układu regulacji metabolizmu tłuszczów.
♦ Otyłość wtórna (objawowa) – konsekwencja różne naruszenia w organizmie, powodując zmniejszenie lipolizy i aktywację lipogenezy (na przykład w cukrzycy, niedoczynności tarczycy, hiperkortyzolizmie).
ETIOLOGIA
Przyczyną otyłości pierwotnej jest nieprawidłowe funkcjonowanie układu podwzgórze-adipocyty.
Otyłość wtórna rozwija się wraz z nadmierną kalorycznością pożywienia i obniżony poziom zużycie energii przez organizm (głównie z hipodynamią).
PATOGENEZA OTYŁOŚCI
Przyporządkuj neurogenne, endokrynologiczne i metaboliczne mechanizmy otyłości.
Neurogenne warianty otyłości
Centrogeniczny Mechanizm (korowy, psychogenny) - jeden z wariantów zaburzeń odżywiania (dwa inne: jadłowstręt psychiczny i bulimia).
♦ Powód: różne zaburzenia psychiczne, objawiające się stałą, czasem nieodpartą chęcią jedzenia.
♦ Możliwe mechanizmy:
❖ aktywacja układów serotoninergicznych, opioidergicznych i innych zaangażowanych w tworzenie odczuć przyjemności i komfortu;
❖ postrzeganie jedzenia jako silnego pozytywnego bodźca (doping), który jeszcze bardziej aktywuje te systemy. to
zamyka błędne koło centrogennego mechanizmu rozwoju otyłości.
podwzgórze(międzymózgowie, podkorowy) mechanizm.
♦ Przyczyna: uszkodzenie neuronów podwzgórza (na przykład po wstrząśnieniu mózgu, zapaleniem mózgu, czaszkogardlakiem, przerzutami nowotworowymi w podwzgórzu).
♦ Najważniejsze ogniwa patogenezy:
❖ Uszkodzenie lub podrażnienie neuronów w tylno-bocznym jądrze brzusznym podwzgórza stymuluje syntezę i sekrecję neuropeptydu Y oraz zmniejsza wrażliwość na leptynę, co hamuje syntezę neuropeptydu Y. Neuropeptyd Y pobudza głód i zwiększa apetyt.
❖ Naruszenie powstawania głodu z powodu nadmiernej produkcji neuroprzekaźników, które wywołują uczucie głodu i zwiększają apetyt (GABA, dopamina, β-endorfina, enkefaliny). Prowadzi to do zmniejszenia syntezy neuroprzekaźników tworzących uczucie sytości i hamujących zachowania żywieniowe (serotonina, noradrenalina, cholecystokinina, somatostatyna).
Endokrynologiczne warianty otyłości
Mechanizmy endokrynologiczne otyłości – leptyna, niedoczynność tarczycy, nadnercza i insulina.
Mechanizm leptyny- Wiodący w rozwoju pierwotnej otyłości.
♦ Leptyna powstają w komórkach tłuszczowych. Zmniejsza apetyt i zwiększa zużycie energii przez organizm. Leptyna hamuje wytwarzanie i uwalnianie neuropeptydu Y przez podwzgórze.
♦ Neuropeptyd Y uczestniczy w powstawaniu głodu. Zwiększa apetyt i zmniejsza zużycie energii przez organizm.
♦ Lipostat. Obwód „leptyna-neuropeptyd Y” utrzymuje masę tkanki tłuszczowej organizmu przy udziale insuliny, katecholamin, serotoniny, cholecystokininy, endorfin. Ogólnie ten system substancji biologicznie czynnych, które zapewniają dynamiczną homeostazę metabolizmu energetycznego i masy tkanki tłuszczowej w organizmie, nazwano układem lipostatycznym.
Mechanizm niedoczynności tarczycy otyłość aktywuje się, gdy działanie hormonów tarczycy zawierających jod jest niewystarczające, co zmniejsza intensywność lipolizy, tempo procesów metabolicznych w tkankach i koszty energetyczne organizmu.
Nadnerkowy(glukokortykoid, kortyzol) mechanizm otyłość włącza się z powodu nadprodukcji glikokortykoidów w korze nadnerczy (na przykład w przypadku choroby i zespołu
Itsenko-Cushing), który promuje lipogenezę z powodu hiperglikemii i włączenia mechanizmu insulinowego.
mechanizm insuliny Rozwój otyłości rozwija się na skutek bezpośredniej aktywacji lipogenezy przez insulinę w tkance tłuszczowej.
Mechanizmy metaboliczne otyłości. Zapasy węglowodanów w organizmie są stosunkowo niewielkie. W związku z tym opracowano mechanizm oszczędzania węglowodanów: wraz ze wzrostem udziału tłuszczów w diecie zmniejsza się tempo utleniania węglowodanów. Kiedy system regulacyjny jest zaburzony, uruchamiany jest mechanizm, który zapewnia wzrost apetytu i wzrost spożycia pokarmu. W tych warunkach tłuszcze nie ulegają rozszczepieniu i gromadzą się w postaci trójglicerydów.
wyczerpanie
wyczerpanie- patologiczny spadek masa tłuszczowa, a także mięśniowa i tkanka łączna poniżej normy. skrajny wyczerpanie jest kacheksja.
Przy wyczerpaniu deficyt tkanki tłuszczowej wynosi ponad 20-25%, a przy kacheksji - ponad 50%. BMI przy uszczupleniu poniżej 19,5 kg/m 2 .
ETIOLOGIA
Zubożenie może być spowodowane przyczynami endogennymi i egzogennymi.
Przyczyny egzogeniczne:
♦ Wymuszony lub świadomy całkowity lub częściowy głód.
♦ Niewystarczająca zawartość kalorii w pożywieniu.
Endogenne przyczyny wyczerpania dzielą się na pierwotne i wtórne.
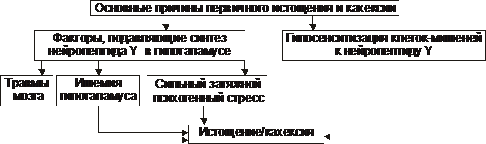
♦ Przyczyna pierwotnego wyczerpania: zahamowanie syntezy neuropeptydu Y w podwzgórzu (w przypadku urazu lub niedokrwienia podwzgórza, silnego długotrwałego stresu) i hiposensytyzacja komórek docelowych na neuropeptyd Y.
♦ Przyczyny wtórnego (objawowego) wyczerpania: złe wchłanianie, niedobór glikokortykoidów, hipoinsulinizm, zwiększona synteza glukagonu i somatostatyny, nadprodukcja TNFα przez komórki nowotworowe.
PATOGENEZA
Wyniszczenie egzogenne i kacheksja. Brak lub znaczny niedobór produktów spożywczych prowadzi do uszczuplenia podaży tłuszczu, zakłócenia wszystkich rodzajów metabolizmu, niedostatecznego utleniania biologicznego i zahamowania procesów plastycznych.
Pierwotne endogenne formy niedożywienia
Największy znaczenie kliniczne mają formy podwzgórzowe, kachektyczne i anorektyczne.
W podwzgórzowej (międzymózgowiejnej, podkorowej) postaci wyczerpania i kacheksji dochodzi do zmniejszenia lub zaprzestania syntezy i uwalniania peptydu Y do krwi przez neurony podwzgórza, co zaburza lipostat.
W przypadku wyczerpania kachektyki (lub cytokin) synteza TNF-a (kachektyny) przez adipocyty i makrofagi prowadzi do zahamowania syntezy neuropeptydu Y w podwzgórzu, zahamowania lipogenezy i aktywacji katabolizmu lipidów.
postać anorektyczna.
♦ U osób z predyspozycją do anoreksji krytyczny stosunek do masy ciała (postrzegany jako nadmierna) prowadzi do rozwoju zaburzeń neuropsychiatrycznych i długie okresy odmowa jedzenia. Najczęściej obserwowany u dorastających dziewcząt i dziewcząt poniżej 18 roku życia.
♦ Dalszy przebieg procesu wiąże się ze zmniejszeniem syntezy neuropeptydu Y i znacznym spadkiem masy ciała, aż do kacheksji.
Wtórne formy endogenne wyczerpanie i kacheksja są objawami innych postaci patologii: zespołów złego wchłaniania, wzrostu nowotworów (syntetyzujący TNFα), hipoinsulinizmu, hipokortycyzmu, braku działania hormonów grasicy.
Lipodystrofia i lipidoza
Lipodystrofia- stany charakteryzujące się uogólnioną lub miejscową utratą tkanki tłuszczowej, rzadziej nadmiernym jej nagromadzeniem w tkance podskórnej.
Lipidozy- stany charakteryzujące się zaburzeniami metabolizmu lipidów w komórkach (lipidoza miąższowa), tkance tłuszczowej (otyłość, niedożywienie) lub ścianach naczynia tętnicze(na przykład miażdżyca).
Dyslipoproteinemia
Dyslipoproteinemia- warunki charakteryzujące się odchyleniem od normy zawartości, struktury i stosunku różnych leków we krwi.
Charakter przepływu i objawy kliniczne dyslipoproteinemie definiuje się:
♦ cechy genetyczne organizm (na przykład skład, stosunek i poziom różnych leków);
♦ czynniki otoczenie zewnętrzne(na przykład zestaw produktów spożywczych, cechy diety i sposób odżywiania);
♦ dostępność choroby współistniejące(np. otyłość, niedoczynność tarczycy, cukrzyca, choroba nerek i wątroby).
Miażdżycorodność lipoprotein
LP dzieli się na miażdżycorodne (VLDL, LDL i LPPP) i przeciwmiażdżycowe (HDL).
Ocenę potencjalnej aterogenności LP krwi przeprowadza się obliczając cholesterolowy współczynnik aterogenności:
cholesterol całkowity - cholesterol HDL
Cholesterol HDL
Normalnie cholesterolowy współczynnik aterogenności nie przekracza 3,0. Wraz ze wzrostem tej wartości wzrasta ryzyko rozwoju miażdżycy.
RODZAJE DISLIPOPROTEINEMII
Według pochodzenia: pierwotne (dziedziczne; mogą być monogeniczne i poligeniczne) i wtórne.
Poprzez zmianę zawartości lipoprotein we krwi: hiperlipoproteinemia, hipo- i alipoproteinemia, dyslipoproteinemia łączona.
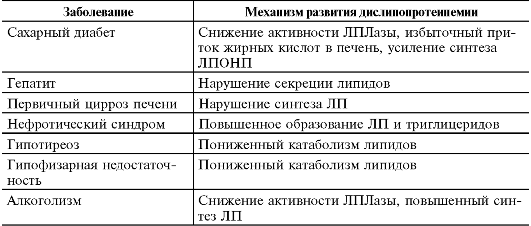
Różne, z reguły, choroby przewlekłe mogą prowadzić do rozwoju wtórnych dyslipoproteinemii (tab. 10-2).
Tabela 10-2. Choroby prowadzące do rozwoju wtórnych dyslipoproteinemii
 Hiperlipoproteinemia
Hiperlipoproteinemia
Hiperlipoproteinemia- stany objawiające się uporczywym wzrostem zawartości LP w osoczu krwi.
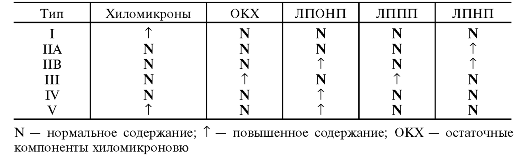
W 1967 Fredrickson i in. opracował klasyfikację hiperlipoproteinemii. Później klasyfikacja ta została zrewidowana przez ekspertów WHO (tab. 10-3).
Tabela 10-3. Rodzaje hiperlipoproteinemii i zawartość w nich różnych lipoprotein
 Hipoproteinemia
Hipoproteinemia
Hipoproteinemia- stany objawiające się uporczywym spadkiem poziomu LP w osoczu krwi aż do ich całkowitego braku (alipoproteinemia).
Połączone dyslipoproteinemie charakteryzuje się naruszeniem stosunku różnych frakcji LP.
Miażdżyca
Miażdżyca- przewlekły proces patologiczny, prowadzący do zmian głównie w wewnętrznej wyściółce tętnic typu elastycznego i mięśniowo-elastycznego na skutek gromadzenia się nadmiaru lipidów, tworzenie tkanka włóknista, a także szereg innych zmian w nich.
Najczęściej dotknięte tętnice w miażdżycy to tętnice wieńcowe, szyjne, nerkowe, krezkowe, kończyny dolne i aortę brzuszną.
ETIOLOGIA
Powody miażdżyca nie została w pełni wyjaśniona. Istnieją trzy hipotezy wyjaśniające występowanie miażdżycy: lipidowa, przewlekłe uszkodzenie śródbłonka i monoklonalna.
Czynniki ryzyka. Wiadomo, że co najmniej 250 czynników przyczynia się do powstania i rozwoju miażdżycy. Do najważniejszych czynników ryzyka należą palenie tytoniu, cukrzyca, nadciśnienie tętnicze otyłość, choroby autoimmunologiczne, hipercholesterolemia, hipertriglicerydemia, hiperhomocysteinemia, hipodynamia, predyspozycje dziedziczne, doustne środki antykoncepcyjne.
PATOGENEZA
Przeznaczyć następne kroki miażdżycowe zmiany naczyniowe: plamy i paski lipidowe, powstawanie miażdżycy i włókniako-miażdżycy, rozwój powikłań (ryc. 10-1).
Plamy i paski lipidowe
Nienaruszony śródbłonek zapobiega przenikaniu LP do błony wewnętrznej tętnic. Pod wpływem czynników ryzyka komórki śródbłonka ulegają uszkodzeniu i dysfunkcja śródbłonka- czynnik wyzwalający miażdżyca.
Powstawanie plam i pasków lipidowych przebiega w kilku etapach:
♦ Migracja do obszarów błony wewnętrznej tętnic z uszkodzonymi komórkami śródbłonka duża liczba monocyty i limfocyty T.
♦ Synteza substancji biologicznie czynnych (czynniki chemotaksji, kininy, Pg, TNFα) i reaktywnych form tlenu przez leukocyty, której towarzyszy intensyfikacja SPO. Czynniki te nasilają uszkodzenie śródbłonka i przenikanie LP do błony wewnętrznej naczyń.
♦ Dodatkowa aktywacja peroksydacji LDL wnikającego do warstwy podśródbłonkowej z tworzeniem zmodyfikowanych lipoprotein.
♦ Wychwyt zmodyfikowanych leków przez monocyty za pomocą „receptorów zmiatających” (receptory czystsze) i ich przekształcenie w komórki piankowe makrofagi bogate w lipidy.
♦ Aktywacja limfocytów T i makrofagów w ognisku uszkodzenia ściany tętnicy z rozwojem aseptycznego zapalenia.
♦ Proliferacja SMC i fibroblastów oraz ich synteza składników tkanki łącznej z powstawaniem plam i pasków lipidowych w błonie wewnętrznej.
Powstawanie miażdżycy i włókniako-miażdżycy
Powstawanie blaszki miażdżycowej wynika z kilku czynników:
Dalsze uszkodzenie śródbłonka mediatorów stanu zapalnego, co nasila przenikanie LDL do błony wewnętrznej naczyń i zamykanie błędnego koła.
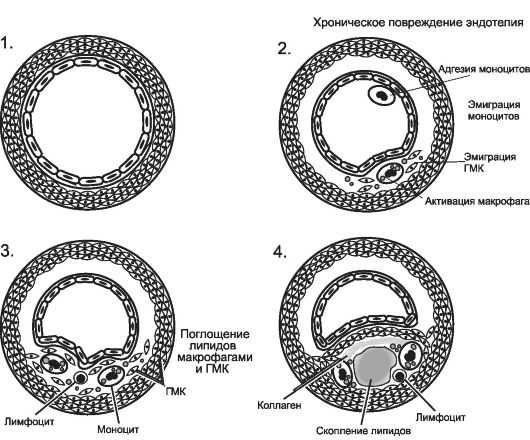 Ryż. 10-1.
Kolejne zmiany w uszkodzonej ścianie tętnicy w miażdżycy. 1 - normalna ściana tętnicy; 2 - adhezja monocytów i płytek krwi do uszkodzonego śródbłonka; 3 - migracja monocytów i SMC do błony wewnętrznej naczyń, infiltracja lipidów; 4 - proliferacja elementów komórkowych, tworzenie rdzenia lipidowego i powstawanie włókniako-miażdżycy. [na 4].
Ryż. 10-1.
Kolejne zmiany w uszkodzonej ścianie tętnicy w miażdżycy. 1 - normalna ściana tętnicy; 2 - adhezja monocytów i płytek krwi do uszkodzonego śródbłonka; 3 - migracja monocytów i SMC do błony wewnętrznej naczyń, infiltracja lipidów; 4 - proliferacja elementów komórkowych, tworzenie rdzenia lipidowego i powstawanie włókniako-miażdżycy. [na 4].
Transformacja GMC do makrofagów i aktywacja syntezy przez nie i fibroblasty składników substancji międzykomórkowej tkanki łącznej (proteoglikany, glikozaminoglikany, kolagen i włókna elastyczne).
Tworzenie rdzenia lipidowego miażdżyca z powodu śmierci komórek piankowatych i uwolnienia z nich wolnych lipidów.
♦ Kaszak charakteryzuje się obecnością znacznej liczby elementów komórkowych: komórki piankowate, SMC on różne etapy proliferacja i transformacja, limfocyty, granulocyty, płytki krwi; tworzenie rdzenia lipidowego z dużą ilością wolnego cholesterolu i jego estrów.
♦ włókniak miażdżycowy charakteryzuje się tworzeniem włóknistej czapeczki nad rdzeniem lipidowym w wyniku syntezy składników tkanki łącznej i rozwoju sieci nowo powstałych naczyń penetrujących płytkę nazębną.
Rozwój powikłań miażdżycy
Modyfikacja blaszki miażdżycowe prowadzi do rozwoju następujących procesów:
♦ zwapnienia, miażdżyca – nagromadzenie związków wapnia w tkance nazębnej;
♦ pęknięcia w powiece włókniakowłókniaka lub jego owrzodzenie, któremu towarzyszy rozwój skrzepliny ciemieniowej z groźbą niedrożności tętnicy lub jej zatoru;
♦ pęknięcia ścian nowo utworzonych mikronaczyń, prowadzące do krwotoków w ścianie tętnicy, powstawania skrzeplin ciemieniowych i śródściennych.
Klinicznie powikłania miażdżycy objawiają się najczęściej niedokrwieniem oraz zawałami narządów i tkanek zaopatrywanych w krew z zajętej tętnicy.
ZASADY ZAPOBIEGANIA I TERAPII MIAżdżycy
Etiotropowy. Ma na celu wyeliminowanie lub ograniczenie wpływu czynników ryzyka. Przykłady środków: stosowanie leków obniżających poziom lipidów, korekta ciśnienia krwi, zaprzestanie palenia, przestrzeganie określonej diety.
Patogenetyczne. Ma na celu zerwanie „łańcucha miażdżycy”. Przykłady interwencji: stosowanie leków przeciwpłytkowych i antykoagulantów; stosowanie specyficznych leków zmniejszających stan zapalny w miażdżycy (na przykład statyny lub przeciwciała monoklonalne przeciwko TNF-a i innym cytokinom prozapalnym).
Termin „metabolizm” odnosi się do wszystkich reakcje chemiczne które mają miejsce w ciele. Bez nich życie Ludzkie ciało staje się niemożliwe, bo tylko dzięki takim procesom istnieją komórki: rosną, kontaktują się ze światem zewnętrznym, odżywiają się i oczyszczają. Istnieje wiele rodzajów metabolizmu, obejmują one białka, tłuszcze i aminokwasy. A w niektórych przypadkach przebieg takich procesów może być zaburzony, co wymaga odpowiedniej korekty. Porozmawiajmy na www.site o tym, czym jest zaburzenie metabolizmu tłuszczów, rozważmy jego leczenie i objawy, a także środki ludowe które pomogą Ci uporać się z tym problemem.
Termin „metabolizm tłuszczów” odnosi się do wytwarzania i rozkładu tłuszczów (lipidów) w organizmie. Procesy rozszczepiania tłuszczów zachodzą głównie w wątrobie, a także w tkance tłuszczowej. I niepowodzenia w normalna wymiana lipidy mogą powodować rozwój miażdżycy, otyłości, a także różnych chorób endokrynologicznych (na przykład cukrzycy). Jak wiadomo, metabolizm tłuszczów charakteryzuje się szczególnie złożoną regulacją. Wpływa na nią insulina, hormony płciowe, a także adrenalina, tyroksyna i inne hormony.
O tym, jak objawia się naruszenie metabolizmu tłuszczów, jakie objawy wskazują na chorobę
Metabolizm tłuszczów zachodzi w prawie wszystkich komórkach i tkankach organizmu. Właśnie z tego powodu objawy jej zaburzeń są trudne do zlokalizowania i trudno je podzielić na pierwotne lub wtórne.
Najbardziej podstawową i zauważalną oznaką zaburzenia jest zauważalny wzrost podskórnej tkanki tłuszczowej, która jest głównym magazynem tłuszczu w organizmie. W przypadku, gdy proces takiej akumulacji zachodzi ze szczególną intensywnością, lekarze podnoszą kwestię otyłości i uważają ją za niezależną chorobę. Otyłość sama w sobie daje o sobie znać jako następna nieprzyjemne objawy. To zakłócenie skutkuje redukcją możliwości fizyczne, prowokuje duszność, chrapanie itp. Pacjenci z tym problemem doświadczają ciągły głód, bo zarośnięty tkanka tłuszczowa wymagają jedzenia.
Otyłość może powodować choroby serca, obturacyjny bezdech senny, bezpłodność i cukrzycę.
Naruszeniu metabolizmu tłuszczów w organizmie towarzyszy gromadzenie się tłuszczu nie tylko w tkance podskórnej, ale także we krwi. W wyniku takiego procesy patologiczne osoba rozwija hiperlipidemię. W tym przypadku badania krwi pacjenta wykazują wzrost stężenia cholesterolu, trójglicerydów, a także lipoprotein o małej gęstości w osoczu.
Otyłość krwi jest tak samo niebezpieczna jak gromadzenie się tłuszczu pod skórą. Wraz ze wzrostem ilości lipidów we krwi ich cząsteczki aktywnie przenikają przez ściany tętnic. Po ich osadzeniu się na powierzchni naczyń krwionośnych, w wyniku czego powstają blaszki miażdżycowe. Takie formacje stopniowo rosną i mogą powodować zablokowanie światła naczyń. W niektórych przypadkach pacjent może doświadczyć całkowitego ustania przepływu krwi - zawału serca lub udaru mózgu.
Warto zauważyć, że czasami naruszenie metabolizmu tłuszczów objawia się brakiem lipidów. W takim przypadku pacjent zaczyna się wyczerpywać, ma niedobór witaminy rozpuszczalne w tłuszczach A, D, E i K. Występuje również usterka cykl miesiączkowy oraz funkcje rozrodcze. Ponadto niedobór lipidów powoduje brak niezbędnych nienasyconych kwasów tłuszczowych, co objawia się wypadaniem włosów, egzemą, zmiany zapalne uszkodzenie skóry i nerek.
O tym, jak korygowane jest naruszenie metabolizmu tłuszczów, jakie leczenie pomaga
Wykazano, że pacjenci z zaburzeniami metabolicznymi eliminują czynniki ryzyka, dodatkowo potrzebują dietetyczne jedzenie. Czasami tylko te środki zachowawczej korekcji są wystarczające, aby zoptymalizować stan pacjenta. Jednak osoba niepełnosprawna procesy metaboliczne najczęściej musisz przestrzegać ograniczeń żywieniowych przez całe życie.
Menu takich pacjentów powinno zawierać znacząca ilość warzywa, owoce, a także zboża i niskotłuszczowe produkty mleczne. Ćwiczenia fizyczne dobierane są indywidualnie, ponadto pacjenci muszą rzucić palenie, pić alkohol i wystrzegać się stresu.
Jeśli takie środki nie pozytywny efekt, lekarze łączą się terapia lekowa. Można stosować statyny kwas nikotynowy a jego pochodne, fibraty, przeciwutleniacze i sekwestranty są czasem lekami z wyboru kwasy żółciowe. Leki mogą być wybrane tylko przez lekarza, a także ich dawkowanie.
Leczenie naruszeń środków ludowych metabolizmu tłuszczów
W leczeniu zaburzeń metabolicznych można stosować leki ziołowe. Tak więc dobry efekt daje napar z herbaty Ivan. Zaparz trzydzieści gramów takich surowców z pół litra wrzącej wody, zagotuj lek i nalegaj na pół godziny. Weź powstałą kompozycję siedemdziesięciu mililitrów cztery razy dziennie.
Możesz także zaparzyć czterdzieści gramów liści babki z dwustu mililitrami wrzącej wody. Domagaj się owinięcia przez pół godziny, a następnie odcedź i weź trzydzieści mililitrów około dwadzieścia minut przed posiłkiem trzy razy dziennie.
Możesz także połączyć piętnaście gramów skrzypu z dwustu mililitrami wrzącej wody. Domagaj się owinięcia przez pół godziny, a następnie odcedź. Weź pięćdziesiąt mililitrów cztery razy dziennie.
Jeśli podejrzewasz rozwój zaburzeń metabolicznych, powinieneś zasięgnąć pomocy medycznej.
Zaburzenia metabolizmu lipidów
Lipidy to chemicznie niejednorodne substancje. W ludzkim ciele występuje wiele różnych lipidów: kwasy tłuszczowe, fosfolipidy, cholesterol, trójglicerydy, sterydy itp. Zapotrzebowanie na tłuszcze waha się od 80-100 g dziennie.
Funkcje lipidów
Strukturalny: Lipidy stanowią podstawę błon komórkowych.
Regulacyjne.
† Lipidy regulują przepuszczalność błon, stan i płynność koloidalną, aktywność enzymów zależnych od lipidów (np. cyklaz adenylanowych i guanylanowych, Na+,K+-ATPaza, Ca2+-ATPaza, oksydaza cytochromowa), aktywność receptorów błonowych (np. dla katecholamin, acetylocholiny, insuliny, cytokin).
† Oddzielne lipidy - substancje biologicznie czynne (np. Pg, leukotrieny, czynnik aktywujący płytki, hormony steroidowe) - regulują funkcje komórek, narządów i tkanek.
Źródło energii. Lipidy są jednym z głównych źródeł energii dla mięśni poprzecznie prążkowanych, wątroby, nerek oraz dodatkowym źródłem energii dla tkanki nerwowej.
Ochronny. Jako część Tkanka podskórna lipidy tworzą bufor
warstwa chroniąca tkanki miękkie przed wpływami mechanicznymi.
izolacyjny. Lipidy tworzą warstwę izolującą termicznie w powierzchniowych tkankach ciała oraz osłonę elektroizolacyjną wokół włókien nerwowych.
Typowe formy patologii
Formularze standardowe Patologie metabolizmu lipidów przedstawiono na ryc. 10–1.
Ryż. 10–1. Typowe formy patologii metabolizmu lipidów.
W zależności od poziomu zaburzeń metabolizmu lipidów rozróżnia się zaburzenia:
† Trawienie i wchłanianie lipidów w przewodzie pokarmowym (np. w wyniku niedoboru lipaz trzustkowych, zaburzeń tworzenia i wydzielania żółci, zaburzeń trawienia jamistego i „błonowego”).
† Transbłonowy transfer lipidów z jelita do krwi i ich wykorzystanie przez komórki (np. przy zapaleniu jelit, zaburzeniach krążenia w ścianie jelita cienkiego).
- Metabolizm lipidów w tkankach (np. z defektem lub niedoborem lipaz, fosfolipaz, LPLazy).
W zależności od objawów klinicznych wyróżnia się otyłość, niedożywienie, dyslipoproteinemię, lipodystrofię i lipidozę.
Otyłość
Normalna zawartość tkanki tłuszczowej u mężczyzn wynosi 15-20% masy ciała, u kobiet 20-30%.
Otyłość - nadmierne (patologiczne) nagromadzenie tłuszczu w organizmie w postaci trójglicerydów. Jednocześnie masa ciała wzrasta o ponad 20-30%.
Według ekspertów WHO w rozwiniętych krajach Europy od 20 do 60% populacji ma nadwagę, w Rosji - około 60%.
Wzrost masy tkanki tłuszczowej sam w sobie nie stanowi zagrożenia dla organizmu, choć zmniejsza jego zdolności adaptacyjne. Jednak otyłość zwiększa ryzyko choroby wieńcowej (1,5 razy), miażdżycy (2 razy), nadciśnienie(3 razy), cukrzyca (4 razy), a także niektóre nowotwory (np. rak piersi, endometrium i prostaty).
Rodzaje otyłości
Główne rodzaje otyłości pokazano na ryc. 10–2.
Ryż. 10–2. Rodzaje otyłości. BMI - wskaźnik masy ciała (patrz tekst).
W zależności od stopnia przyrostu masy ciała istnieją trzy stopnie otyłości. W tym przypadku stosuje się pojęcie „idealnej masy ciała”.
Do oszacowania idealnej masy ciała stosuje się różne wzory.
† Najprostszy - indeks Borsuk : odejmij 100 od wysokości (w cm).
† Wskaźnik masy ciała jest również obliczany według następującego wzoru:
Masę ciała uważa się za prawidłową, ze wskaźnikiem masy ciała w zakresie 18,5–24,9. Jeśli te wartości zostaną przekroczone, mówią o nadwadze (tabela 10-1).
Tabela 10-1. Stopnie otyłości
Notatka. BMI - wskaźnik masy ciała
Zgodnie z dominującą lokalizacją tkanki tłuszczowej wyróżnia się otyłość ogólną (jednolitą) i lokalną (lokalna lipohipertrofia). Odmiany miejscowej otyłości:
† Typ żeński (gynoid) – nadmiar tłuszczu podskórnego głównie w udach i pośladkach.
† Typ męski (android) - nagromadzenie tłuszczu w jamie brzusznej.
Zgodnie z dominującym wzrostem liczby lub wielkości komórek tłuszczowych, występują:
† Otyłość hiperplastyczna (z powodu dominującego wzrostu liczby adipocytów). Jest bardziej odporny na leczenie i w ciężkich przypadkach wymaga operacji usunięcia nadmiaru tłuszczu.
† Hipertroficzny (z powodu dominującego wzrostu masy i wielkości adipocytów). Częściej występuje po 30 roku życia.
† Hiperplastyczny-hipertroficzny (mieszany). Dość często wychodzi na jaw i to w wieku dziecięcym.
Według genezy rozróżnia się otyłość pierwotną i jej formy wtórne.
† Otyłość pierwotna (podwzgórze) jest wynikiem zaburzeń układu regulacji metabolizmu tłuszczów (lipostat) – niezależnej choroby pochodzenia neuroendokrynnego.
† Otyłość wtórna (objawowa) jest konsekwencją różnych zaburzeń w organizmie, powodujących:
‡ redukcja kosztów energii (a co za tym idzie – zużycia trójglicerydów tkanki tłuszczowej),
‡ aktywacja syntezy lipidów – lipogeneza (obserwowana w wielu chorobach, np. w cukrzycy, niedoczynności tarczycy, hiperkortyzolizmie).
Przyczyny otyłości
Przyczyną pierwotnej otyłości jest naruszenie funkcjonowania układu „adipocyty – podwzgórze”. Jest to wynik niedoboru i/lub niedoboru działania leptyny (poprzez hamowanie produkcji neuropeptydu Y przez neurony w podwzgórzu, co zwiększa apetyt i głód).
Otyłość wtórna rozwija się wraz z nadmierną kalorycznością pożywienia i P zmniejszony poziom zużycia energii przez organizm. Zużycie energii zależy od stopnia aktywności (przede wszystkim fizycznej) i stylu życia osoby. Niewystarczająca aktywność fizyczna jest jednym z ważne powody otyłość.
Patogeneza otyłości
Przyporządkuj neurogenne, endokrynologiczne i metaboliczne mechanizmy otyłości.
Neurogenne warianty otyłości
Neurogenne (centrogeniczne i podwzgórzowe) mechanizmy otyłości przedstawiono na ryc. 10–3.
Ryż. 10–3. Neurogenne mechanizmy otyłości.
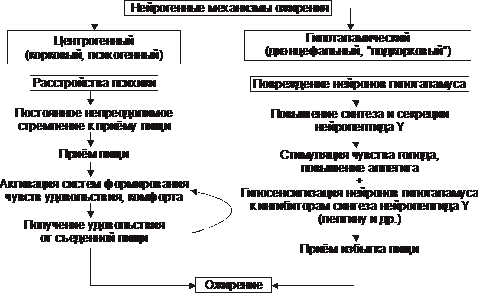
† Centrogeniczny Mechanizm (korowy, psychogenny) - jeden z wariantów zaburzeń odżywiania (dwa inne: jadłowstręt psychiczny i bulimia). Powód: różne zaburzenia psychiczne, objawiające się stałą, czasem nieodpartą chęcią jedzenia. Możliwe mechanizmy:
‡ aktywacja układów serotoninergicznych, dopaminergicznych, opioidergicznych i innych zaangażowanych w tworzenie odczuć przyjemności i komfortu;
‡ postrzeganie jedzenia jako silnego pozytywnego bodźca (doping), który dodatkowo aktywuje te systemy – błędne koło centrogenicznego mechanizmu rozwoju otyłości zostaje zamknięte.
† podwzgórze(międzymózgowie, podkorowy) mechanizm. Jego przyczyną jest uszkodzenie neuronów jąder brzuszno-przyśrodkowych i przykomorowych podwzgórza (na przykład po wstrząśnieniu mózgu, z zapaleniem mózgu, czaszkogardlakiem, przerzutami nowotworowymi w podwzgórzu). Najważniejsze ogniwa patogenezy:
‡ Spontaniczny (bez wyjaśnionej przyczyny) wzrost syntezy i wydzielania neuropeptydu Y przez neurony w tylno-bocznym jądrze brzusznym podwzgórza.
‡ Uszkodzenie lub podrażnienie neuronów powyższego jądra stymuluje również syntezę i sekrecję neuropeptydu Y oraz zmniejsza wrażliwość na czynniki hamujące syntezę neuropeptydu Y (głównie leptyny).
§ Neuropeptyd Y pobudza głód i zwiększa apetyt.
§ Leptyna hamuje powstawanie stymulatora apetytu – neuropeptydu Y.
‡ Naruszenie udziału podwzgórza w powstawaniu głodu. To uczucie powstaje wraz ze spadkiem GPC, skurczem mięśni żołądka podczas ewakuacji pokarmu i jego opróżniania (uczucie dyskomfortu związanego z jedzeniem - „ssie w dole żołądka”). Informacje z obwodowych zakończeń nerwów czuciowych są integrowane z jądrami nerwowymi podwzgórza odpowiedzialnymi za zachowanie żywieniowe.
‡ W wyniku powyższych procesów dochodzi do produkcji neuroprzekaźników i neuropeptydów, które wywołują uczucie głodu i zwiększają apetyt (GABA, dopamina, - endorfiny, enkefaliny) i/lub neuroprzekaźników i neuropeptydów, które wywołują uczucie sytości i przygnębiają jedzenie zachowanie (serotonina, noradrenalina, cholecystokinina, somatostatyna)).
Endokrynologiczne warianty otyłości
Mechanizmy endokrynologiczne otyłości – leptyna, niedoczynność tarczycy, nadnercza i insulina – przedstawiono na ryc. 10-4.
![]()
Ryż. 10-4. patogeneza otyłości.
† Mechanizm leptyny - wiodący w rozwoju pierwotnej otyłości.
‡ Leptyna powstają w komórkach tłuszczowych. Zmniejsza apetyt i zwiększa zużycie energii przez organizm. Poziom leptyny we krwi jest bezpośrednio skorelowany z ilością białej tkanki tłuszczowej. Wiele komórek ma receptory leptyny, w tym neurony w jądrze brzuszno-przyśrodkowym podwzgórza. Leptyna hamuje wytwarzanie i uwalnianie neuropeptydu Y przez podwzgórze.
‡ NeuropeptydTak wywołuje uczucie głodu, zwiększa apetyt, zmniejsza zużycie energii organizmu. Między podwzgórzem a tkanką tłuszczową występuje rodzaj ujemnego sprzężenia zwrotnego: nadmierne przyjmowanie pokarmu, któremu towarzyszy wzrost masy tkanki tłuszczowej, prowadzi do zwiększonego wydzielania leptyny. To (poprzez zahamowanie produkcji neuropeptydu Y) zmniejsza uczucie głodu. Jednak u osób otyłych ten mechanizm regulacyjny może być zaburzony, np. z powodu zwiększonej oporności na leptynę lub mutacji w genie leptyny.
‡ Lipostat. Obwód „leptyna-neuropeptyd Y” utrzymuje masę tkanki tłuszczowej organizmu – lipostat (czyli nastawę organizmu pod względem intensywności metabolizmu energetycznego). Oprócz leptyny system lipostatu zawiera insulinę, katecholaminy, serotoninę, cholecystokininę i endorfiny.
† Mechanizm niedoczynności tarczycy otyłość jest wynikiem niedostatecznego działania hormonów tarczycy zawierających jod. Zmniejsza to intensywność lipolizy, tempo procesów metabolicznych w tkankach oraz koszty energetyczne organizmu.
† Nadnerkowy(glukokortykoid, kortyzol) mechanizm otyłość jest aktywowana z powodu nadprodukcji glikokortykoidów w korze nadnerczy (na przykład w chorobie lub zespole Itenko ‑Cushing ). Pod wpływem nadmiaru glikokortykoidów dochodzi do aktywacji glukoneogenezy (w wyniku tego dochodzi do hiperglikemii), transportu glukozy do adipocytów i glikolizy (zahamowanie reakcji lipolitycznych i akumulacja trójglicerydów).
† mechanizm insuliny Rozwój otyłości rozwija się na skutek bezpośredniej aktywacji lipogenezy przez insulinę w tkance tłuszczowej.
† Inne mechanizmy. Otyłość może również rozwinąć się z innymi endokrynopatiami (na przykład z niedoborem hormonu wzrostu i hormonów gonadotropowych). Mechanizmy rozwoju otyłości w tych stanach opisano w rozdziale 27 „Endokrynopatia”).
Metaboliczne mechanizmy otyłości
† Zapasy węglowodanów w organizmie są stosunkowo niewielkie. Są one w przybliżeniu równe ich dziennemu spożyciu z pożywieniem. W związku z tym opracowano mechanizm oszczędzania węglowodanów.
† Wraz ze wzrostem udziału tłuszczu w diecie zmniejsza się tempo utleniania węglowodanów. Świadczy o tym odpowiedni spadek współczynnika oddychania (stosunek szybkości tworzenia CO 2 do szybkości zużycia O 2).
† Jeśli tak się nie stanie (gdy mechanizm hamowania glikogenolizy jest zaburzony w warunkach wysokie stężenie tłuszcze we krwi), aktywowany jest mechanizm, który zapewnia wzrost apetytu i wzrost spożycia pokarmu, mający na celu dostarczenie wymaganej ilości węglowodanów w organizmie.
† W tych warunkach tłuszcze są przechowywane jako trójglicerydy. Otyłość się rozwija.
wyczerpanie
Wyniszczenie i wyniszczenie – patologiczny spadek masy tkanki tłuszczowej poniżej normy. Jednocześnie znacznie zmniejsza się masa mięśni i tkanki łącznej.
Przy wyczerpaniu deficyt tkanki tłuszczowej może wynosić 20-25% lub więcej (przy wskaźniku masy ciała poniżej 20 kg / m2), a przy kacheksji - poniżej 50%.
Przyczyny i rodzaje wyniszczenia i wyniszczenia
Rozróżnij endogenne i egzogenne przyczyny wyczerpania.
Przyczyny egzogeniczne
† Wymuszone lub świadome całkowite lub częściowe głodzenie (w tym ostatnim przypadku najczęściej w celu utraty wagi).
‡ Całkowity głód - stan, w którym żywność nie dostaje się do organizmu (na przykład w przypadku ich braku, odmowa jedzenia, niemożność jedzenia).
‡ Głód niepełny to stan charakteryzujący się znacznym niedoborem substancji plastycznych i kalorii w pożywieniu (np. niedożywienie, ilościowo i jakościowo, jednorodne jedzenie, wegetarianizm).
† Niskokaloryczne jedzenie, które nie uzupełnia kosztów energetycznych organizmu.
Przyczyny endogenne
Wyczerpanie endogennej genezy dzieli się na pierwotne i wtórne.
† Przyczyny wyniszczenia pierwotnego (podwzgórza, międzymózgowia) omówiono na ryc. 10-5.
Ryż. 10-5. Główne przyczyny wyczerpania pierwotnego i wyniszczenia.
† Przyczyny marnowania wtórnego (objawowego) przedstawiono na ryc. 10–6.
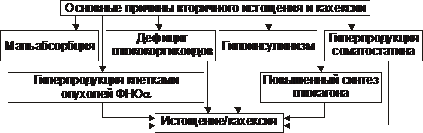
Ryż. 10–6. Główne przyczyny wtórnego wyczerpania i wyniszczenia.
Patogeneza wyniszczenia i wyniszczenia
Egzogenne wyniszczenie i kacheksja. Brak lub znaczny niedobór produktów spożywczych prowadzi do rozwoju łańcucha procesów sekwencyjnych i współzależnych, omówionych na ryc. 10–7.
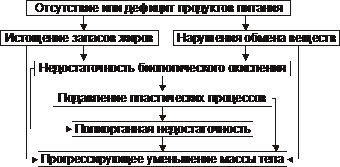
Ryż. 10–7. Główne ogniwa w patogenezie wyczerpania egzogennego i wyniszczenia.
Pierwotne formy endogenne wyczerpanie i kacheksja. Największe znaczenie kliniczne mają postacie podwzgórza, wyniszczenia i anoreksji.
† Forma podwzgórza
W podwzgórzowej (międzymózgowie, podkorowej) postaci wyczerpania i kacheksji dochodzi do zmniejszenia lub zaprzestania syntezy i uwalniania peptydu Y do krwi przez neurony podwzgórza, co prowadzi do kolejnych procesów pokazanych na ryc. 10-8.

Ryż. 10-8. Główne ogniwa mechanizmu podwzgórza wyczerpania i wyniszczenia.
† Forma kachektyny
Patogenezę kachektycznej lub cytokinowej formy wyniszczenia i kacheksji omówiono na ryc. 10-9.
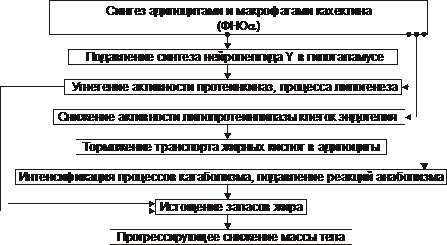
Ryż. 10-9. Główne ogniwa mechanizmu kachektycznego wyczerpania i wyniszczenia.
† Postać anorektyczna
Główne ogniwa w patogenezie niedożywienia anorektycznego i wyniszczenia przedstawiono na ryc. 10-10.
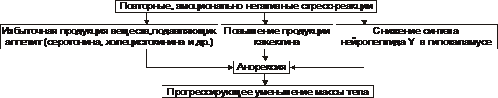
Ryż. 10-10. Główne ogniwa anorektycznego mechanizmu wyczerpania i wyniszczenia.
‡ Osoby z predyspozycją do rozwoju anoreksji mają krytyczny stosunek do swojego ciała (postrzegane jako posiadające nadwaga) powoduje rozwój zaburzeń neuropsychiatrycznych. Prowadzi to do przedłużających się epizodów odmowy jedzenia. Najczęściej obserwowany u dorastających dziewcząt i dziewcząt do 16-18 roku życia.
‡ Przy powtarzających się i negatywnie zabarwionych emocjonalnie reakcjach stresowych obserwuje się nadmierne wytwarzanie serotoniny i cholecystokininy, które hamują apetyt.
‡ Dalszy przebieg procesu może prowadzić do realizacji efektów działania neuropeptydu Y i kachektyny. Te czynniki najprawdopodobniej leżą u podstaw patogenezy jadłowstrętu psychicznego. Wraz z przedłużającym się procesem rozwija się wyraźny spadek masy ciała, aż do wyniszczenia.
Wtórne formy endogenne Wyczerpanie i kacheksja są ważnymi, często głównymi objawami innych stanów patologicznych i chorób (ryc. 10-11).

Ryż. 10-11. Główne przyczyny wtórnego wyniszczenia endogennego i wyniszczenia.
Lipodystrofia
Lipodystrofia to stan charakteryzujący się uogólnioną lub miejscową utratą tkanki tłuszczowej, rzadziej przez nadmierne jej nagromadzenie w tkance podskórnej. Przyczyny lipodystrofii są różne i nie zawsze są znane, od mutacji w różnych genach (np. laminach) po powikłania po wstrzyknięciu. Istnieje duża grupa dziedzicznych i wrodzonych zespołów lipodystrofii, niektóre z nich zostały omówione w artykule „Lipodystrofia” (załącznik „Podręcznik” na płycie CD).
Lipidozy
Lipidozy są typową postacią zaburzeń metabolizmu lipidów charakteryzujących się zaburzeniami metabolizmu różnych lipidów (np. sfingolipidozy, gangliozydozy, mukolipidozy, adrenoleukodystrofia, leukodystrofia, lipofuscynoza, cerebrozydozy) w komórkach (lipidoza miąższowa), tkance tłuszczowej (otyłość), niedożywienie lub ściany naczyń tętniczych (miażdżyca), miażdżyca. Te formy lipidozy są opisane w tym podręczniku (Rozdział 4 „Uszkodzenie komórek” w tym rozdziale, a także w artykułach w dodatku Słowniczek terminów na płycie CD).
Dyslipoproteinemia
Dyslipoproteinemia - stany charakteryzujące się odchyleniem od normy zawartości, struktury i stosunku różnych leków we krwi. Zaburzenia metabolizmu LP są głównym ogniwem w patogenezie miażdżycy, choroby wieńcowej, zapalenia trzustki i innych chorób.
Charakter przebiegu i objawy kliniczne dyslipoproteinemii określają:
Dziedziczne właściwości organizmu (na przykład skład, stosunek i poziom różnych leków; charakterystyka ich metabolizmu).
Czynniki środowiskowe (na przykład zestaw środków spożywczych, cechy diety i sposób odżywiania).
Obecność (lub brak) chorób współistniejących (np. otyłość, niedoczynność tarczycy, cukrzyca, uszkodzenie nerek i wątroby).
Charakterystyka lipoprotein
W osoczu krwi krążą różne lipidy. Wolne kwasy tłuszczowe są transportowane przez albuminy, a trójglicerydy, cholesterol, estry cholesterolu i fosfolipidy, niewielka ilość kwasów tłuszczowych jest transportowana jako część LP. Te kuliste cząstki składają się z hydrofobowego rdzenia (zawiera estry cholesterolu i triglicerydy) oraz hydrofilowej powłoki (zawiera cholesterol, fosfolipidy i apolipoproteiny). Główne cechy różnych leków podano w tabeli. 10–2.
Tabela 10-2. Rodzaje i główne właściwości lipoprotein
|
Chylomikrony | |||||
|
Wielkość cząstek (nm) |
75–1200 | ||||
|
Gęstość (g/cm 3 ) |
0,98–1,006 |
1,006–1,019 |
1,019–1,063 |
1,063–1,210 |
|
|
Mieszanina (%): | |||||
|
Cholesterol | |||||
|
Trójglicerydy | |||||
|
Fosfolipidy | |||||
|
ApoLP |
B48, AI, AII, AIV, CI, CII, CIII, E |
B100, CI, CII, CIII, E |
AI, AII, AIV, CI, CII, CIII, E |
||
|
Źródło |
Jelito cienkie, lipidy dietetyczne |
Wątroba, jelito cienkie |
VLDL, LPPP |
Jelito cienkie, wątroba |
|
|
miażdżycorodność |
nie udowodniono |
nie udowodniono |
Przeciwmiażdżycowe |
||
Apolipoproteiny zapewniają zachowanie uporządkowanej struktury miceli LP, interakcję LP z receptorami komórkowymi oraz wymianę składników między LP. Szczegółowe specyfikacje apoLP i ich defekty podano w artykule „Defekty w apolipoproteinach” (patrz Załącznik „Książka informacyjna” na płycie CD-ROM).
Miażdżycorodność lipoprotein
LP dzieli się na miażdżycorodne i przeciwmiażdżycowe (ryc. 10–12).

Ryż. 10-12. Rodzaje lipoprotein w zależności od ich aterogenności.
O działaniu przeciwmiażdżycowym HDL decydują ich następujące właściwości:
† Zdolność do usuwania nadmiaru cholesterolu z błony komórkowej komórek, w tym śródbłonka naczyniowego, i transportu go do wątroby, gdzie cholesterol jest usuwany z żółcią.
† Wyższe powinowactwo HDL do receptorów apoLP E i apoLP B w porównaniu z LDL. To jest zdefiniowane wysoka zawartość apoLP E do HDL. W rezultacie HDL zapobiega wchłanianiu przez komórki cząsteczek nasyconych cholesterolem.
Ocenę potencjalnej aterogenności LP krwi przeprowadza się obliczając cholesterolowy współczynnik aterogenności:
Normalnie cholesterolowy współczynnik aterogenności nie przekracza 3,0. Wraz ze wzrostem tej wartości wzrasta ryzyko rozwoju miażdżycy.
Rodzaje dyslipoproteinemii
Główne rodzaje dyslipoproteinemii przedstawiono na ryc. 10-13.

Ryż. 10-13. Rodzaje dyslipoproteinemii.
Ponad 30% pierwotnych dyslipoproteinemii to dziedziczne formy patologii (zarówno monogenowe, jak i wielogenowe o wieloczynnikowej genezie).
Około 70% dyslipoproteinemii uważa się za nabyte. Wtórne (nabyte) dyslipoproteinemie są objawami innych chorób. Towarzyszą wielu chorobom człowieka (tab. 10-3).
Tabela 10-3. Najczęstsze procesy patologiczne prowadzące do rozwoju wtórnej dyslipoproteinemii
|
Choroba |
Mechanizm rozwoju |
|
|
Cukrzyca |
I, IV, V |
Zmniejszona aktywność LPLazy, nadmierny napływ kwasów tłuszczowych do wątroby, zwiększona synteza VLDL |
|
zaburzenia wydzielania lipidów |
||
|
Pierwotna marskość wątroby |
Naruszenie syntezy LP |
|
|
zespół nerczycowy |
II, IV, V |
Zwiększone tworzenie LP i trójglicerydów |
|
Niedoczynność tarczycy |
II, IV | |
|
Niewydolność przysadki |
Zmniejszony katabolizm lipidów |
|
|
Przewlekły alkoholizm |
IV, V |
Zmniejszona aktywność LPLazy, zwiększona synteza LP |
Różne wady dziedziczne, a także nabyte procesy patologiczne i choroby często prowadzą do podobnych zmian w zawartości i profilu różnych leków. W związku z tym wymagane jest drobne zróżnicowanie ich pochodzenia, co umożliwia ich skuteczne leczenie.
Hiperlipoproteinemia
Hiperlipoproteinemia - stany charakteryzujące się zaburzeniem w tworzeniu, transporcie i metabolizmie LP i objawiające się uporczywym wzrostem poziomu cholesterolu i/lub trójglicerydów w osoczu.
Klasyfikacja
W 1967 Fredrickson i wsp. opracowali klasyfikację hiperlipoproteinemii (hiperlipidemii). Dane dotyczące treści oparto na cholesterol całkowity i triglicerydów w osoczu krwi, a także rozkład frakcji LP podczas ich elektroforezy i ultrawirowania. Na tej podstawie zidentyfikowano pięć typów hiperlipoproteinemii. Później klasyfikacja ta została zrewidowana przez ekspertów WHO (tab. 10-4).
Naruszenia i ich przyczyny w kolejności alfabetycznej:
zaburzenia metabolizmu lipidów
Cała linia choroba jest spowodowana zaburzenie metabolizmu lipidów. Najważniejsze z nich to miażdżyca i otyłość. Choroby układu sercowo-naczyniowego, jako konsekwencja miażdżycy, zajmują pierwsze miejsce w strukturze śmiertelności na świecie. Jednym z najczęstszych objawów miażdżycy jest naczynia wieńcowe kiery. Nagromadzenie cholesterolu w ścianach naczyń krwionośnych prowadzi do powstawania blaszek miażdżycowych. Rosnące z czasem mogą blokować światło naczynia i zakłócać normalny przepływ krwi. Jeśli w rezultacie przepływ krwi zostanie zakłócony w tętnice wieńcowe, to jest dusznica bolesna lub zawał mięśnia sercowego. Predyspozycja do miażdżycy zależy od stężenia form transportowych lipidów krwi – alfa-lipoprotein osocza.
Jakie choroby powodują naruszenie metabolizmu lipidów:
Nagromadzenie cholesterolu (CS) w ścianie naczyniowej następuje z powodu braku równowagi między jego wejściem do błony wewnętrznej naczyń a jego wyjściem. W wyniku tej nierównowagi gromadzi się tam cholesterol. W centrach akumulacji cholesterolu powstają struktury - miażdżyce. Istnieją dwa najbardziej znane czynniki, które powodują zaburzenia metabolizmu lipidów.
1. Po pierwsze są to zmiany w cząsteczkach LDL (glikozylacja, peroksydacja lipidów, hydroliza fosfolipidów, utlenianie apo B). Dlatego są wychwytywane przez specjalne komórki – „zmiataczy” (głównie makrofagi). Wychwytywanie cząsteczek lipoprotein za pomocą receptorów „śmieciowych” przebiega w sposób niekontrolowany. W przeciwieństwie do endocytozy, w której pośredniczy apo B/E - nie powoduje to opisanych powyżej efektów regulacyjnych mających na celu zmniejszenie wnikania cholesterolu do komórki. W rezultacie makrofagi zostają przeciążone lipidami, tracą funkcję pochłaniania odpadów i zamieniają się w komórki piankowate. Te ostatnie pozostają w ścianie naczynia krwionośne i zaczynają wydzielać czynniki wzrostu, które przyspieszają podział komórek. Następuje proliferacja komórek miażdżycowych.
2. Po drugie, jest to nieefektywne uwalnianie cholesterolu ze śródbłonka ściana naczyniowa krąży w krew HDL.
Czynniki wpływające podwyższony poziom LDL u ludzi
Płeć - wyższa u mężczyzn niż u kobiet przed menopauzą i niższa niż u kobiet po menopauzie
- Starzenie się
- Tłuszcze nasycone w diecie
- wysokie zużycie cholesterol
- Dieta uboga w grubo włókniste pokarmy
- Spożycie alkoholu
- Ciąża
- Otyłość
- Cukrzyca
- Niedoczynność tarczycy
- choroba Cushinga
- mocznica
- Nefroza
- Dziedziczne hiperlipidemie
Zaburzenia metabolizmu lipidów (dyslipidemia), charakteryzujące się przede wszystkim: wysoka zawartość cholesterol i trójglicerydy we krwi są najważniejsze czynniki ryzyko miażdżycy i powiązanych chorób układu sercowo-naczyniowego. Stężenie całkowitego cholesterolu (CH) lub jego frakcji w osoczu ściśle koreluje z zachorowalnością i śmiertelnością z powodu choroby wieńcowej i innych powikłań miażdżycy. Dlatego charakterystyką zaburzeń metabolizmu lipidów jest warunek wstępny skuteczna profilaktyka choroby sercowo-naczyniowe.
Zaburzenia metabolizmu lipidów mogą być pierwotne i wtórne i charakteryzują się jedynie wzrostem cholesterolu (hipercholesterolemia izolowana), triglicerydów (hipertriglicerydemia izolowana), triglicerydów i cholesterolu (hiperlipidemia mieszana).
Pierwotne zaburzenie metabolizmu lipidów jest uwarunkowane pojedynczą lub wielokrotną mutacją odpowiednich genów, co skutkuje nadprodukcją lub upośledzeniem wykorzystania triglicerydów i Cholesterol LDL lub nadprodukcja i zaburzony klirens HDL.
Pierwotne zaburzenia lipidowe można zdiagnozować u pacjentów z: objawy kliniczne te naruszenia, wczesny start miażdżyca (do 60 lat), u osób z rodzinnym wywiadem miażdżycy lub ze wzrostem stężenia cholesterolu w surowicy > 240 mg/dl (> 6,2 mmol/l).
Wtórne zaburzenie metabolizmu lipidów występuje z reguły w populacji krajów rozwiniętych w wyniku: siedzący tryb życiażycie, spożywanie żywności zawierającej dużą ilość cholesterolu, nasyconych kwasów tłuszczowych.
Innymi przyczynami wtórnych zaburzeń metabolizmu lipidów mogą być:
1. Cukrzyca.
2. Nadużywanie alkoholu.
3. Przewlekła niewydolność nerek.
4. Nadczynność tarczycy.
5. Pierwotna marskość żółciowa wątroby.
6. Przyjmowanie niektórych leków (beta-blokerów, leki przeciwretrowirusowe estrogeny, progestyny, glukokortykoidy).
Dziedziczne zaburzenia metabolizmu lipidów:
Mała liczba osób ma zaburzenia dziedziczne metabolizm lipoprotein, objawiający się hiper- lub hipolipoproteinemią. Ich przyczyną jest naruszenie syntezy, transportu lub rozszczepiania lipoprotein.
Zgodnie z ogólnie przyjęta klasyfikacja, rozróżnij 5 rodzajów hiperlipoproteinemii.
1. Istnienie typu 1 wynika z niedostatecznej aktywności LPL. W rezultacie chylomikrony są bardzo powoli usuwane z krwiobiegu. Gromadzą się we krwi, a poziom VLDL jest również wyższy niż normalnie.
2. Hiperlipoproteinemia typu 2 dzieli się na dwa podtypy: 2a, charakteryzujący się wysoką zawartością w LDL krwi i 2b (podwyższony LDL i VLDL). Hiperlipoproteinemia typu 2 objawia się wysoką, a w niektórych przypadkach bardzo wysoką, hipercholesterolemią z rozwojem miażdżycy i choroba wieńcowa kiery. Zawartość triacylogliceroli we krwi mieści się w granicach normy (typ 2a) lub umiarkowanie podwyższona (typ 2b). Hiperlipoproteinemia typu 2 jest charakterystyczna dla poważna choroba- dziedziczna hipercholesterolemia dotykająca młodych ludzi. W przypadku formy homozygotycznej kończy się fatalny w młody wiek od zawałów mięśnia sercowego, udarów i innych powikłań miażdżycy. Hiperlipoproteinemia typu 2 jest powszechna.
3. W przypadku hiperlipoproteinemii typu 3 (dysbetalipoproteinemia) konwersja VLDL do LDL jest zaburzona, a we krwi pojawiają się patologiczne pływające LDL lub VLDL. We krwi wzrasta zawartość cholesterolu i triacylogliceroli. Ten typ jest dość rzadki.
4. W przypadku hiperlipoproteinemii typu 4 główną zmianą jest wzrost VLDL. W efekcie znacznie wzrasta zawartość triacylogliceroli w surowicy krwi. Wiąże się z miażdżycą naczyń wieńcowych, otyłością, cukrzyca. Rozwija się głównie u dorosłych i występuje bardzo często.
5. Hiperlipoproteinemia typu 5 – wzrost zawartości HM i VLDL w surowicy, związany z umiarkowanym zmniejszona aktywność lipazy lipoproteinowe. Stężenie LDL i HDL jest poniżej normy. Zwiększa się zawartość triacylogliceroli we krwi, natomiast stężenie cholesterolu utrzymuje się w granicach normy lub umiarkowanie podwyższone. Występuje u dorosłych, ale rozpowszechniony nie ma.
Typowanie hiperlipoproteinemii przeprowadza się w laboratorium na podstawie badania poziomów we krwi różnych klas lipoprotein metodami fotometrycznymi.
Jako predyktor zmian miażdżycowych naczyń wieńcowych bardziej pouczający jest wskaźnik cholesterolu w składzie HDL. Jeszcze bardziej pouczający jest współczynnik odzwierciedlający stosunek leków miażdżycogennych do leków przeciwmiażdżycowych.
Im wyższy ten stosunek, tym więcej niebezpieczeństwa występowanie i progresja choroby. U osób zdrowych nie przekracza 3-3,5 (u mężczyzn jest wyższy niż u kobiet). Na pacjenci z chorobą wieńcową osiąga 5-6 lub więcej jednostek.
Czy cukrzyca jest chorobą metabolizmu lipidów?
Objawy zaburzeń metabolizmu lipidów są tak wyraźne w cukrzycy, że często nazywa się cukrzycę więcej chorób lipidowy niż metabolizm węglowodanów. Głównymi zaburzeniami metabolizmu lipidów w cukrzycy są nasilenie rozpadu lipidów, zwiększenie tworzenia ciał ketonowych oraz zmniejszenie syntezy kwasów tłuszczowych i triacylogliceroli.
Na zdrowa osoba zwykle 50% przychodzącej glukozy jest rozkładane przez CO2 i H2O; około 5% jest przekształcane w glikogen, a reszta jest przekształcana w lipidy w magazynach tłuszczu. W cukrzycy tylko 5% glukozy jest przekształcane w lipidy, podczas gdy ilość glukozy rozkładającej się na CO2 i H2O również maleje, a ilość przekształcana w glikogen zmienia się nieznacznie. Skutkiem nieprawidłowego spożycia glukozy jest wzrost poziomu glukozy we krwi i jej usuwanie z moczem. Wewnątrzkomórkowy niedobór glukozy prowadzi do zmniejszenia syntezy kwasów tłuszczowych.
U nieleczonych pacjentów obserwuje się wzrost stężenia triacylogliceroli i chylomikronów w osoczu, a osocze jest często lipemiczne. Wzrost poziomu tych składników powoduje zmniejszenie lipolizy w składach tłuszczu. Spadek aktywności lipazy lipoproteinowej dodatkowo przyczynia się do zmniejszenia lipolizy.
peroksydacja lipidów
cecha lipidów błony komórkowe jest ich znaczne nienasycenie. Nienasycone kwasy tłuszczowe łatwo ulegają degradacji nadtlenkowej – LPO (peroksydacja lipidów). Dlatego reakcja błony na uszkodzenie nazywana jest „stresem nadtlenkowym”.
LPO opiera się na mechanizmie wolnorodnikowym.
Patologia wolnorodnikowa to palenie tytoniu, nowotwory, niedokrwienie, hiperoksja, starzenie się, cukrzyca tj. w prawie wszystkich chorobach występuje niekontrolowana formacja wolne rodniki tlen i intensyfikacja LPO.
Komórka posiada system ochrony przed uszkodzeniem przez wolne rodniki. System antyoksydacyjny komórek i tkanek organizmu obejmuje 2 ogniwa: enzymatyczny i nieenzymatyczny.
Antyoksydanty enzymatyczne:
- SOD (dysmutaza ponadtlenkowa) i ceruloplazmina zaangażowane w neutralizację wolnych rodników tlenowych;
- katalaza katalizująca rozkład nadtlenku wodoru; system glutationowy zapewniający katabolizm nadtlenków lipidów, nukleotydów modyfikowanych nadtlenkami i sterydów.
Nawet krótkotrwały brak antyoksydantów nieenzymatycznych, zwłaszcza witamin antyoksydacyjnych (tokoferol, retinol, askorbinian), prowadzi do trwałego i nieodwracalnego uszkodzenia błon komórkowych.
Z którymi lekarzami się skontaktować w przypadku naruszenia metabolizmu lipidów:
Czy zauważyłeś naruszenie metabolizmu lipidów? Chcesz poznać bardziej szczegółowe informacje lub potrzebujesz inspekcji? Możesz umów wizytę u lekarza– przychodnia Eurolaboratorium zawsze do usług! Najlepsi lekarze zbadać cię, uczyć się znaki zewnętrzne i pomóc zidentyfikować chorobę po objawach, doradzić i zapewnić potrzebna pomoc. ty też możesz zadzwoń do lekarza w domu. Klinika Eurolaboratorium otwarte dla Ciebie przez całą dobę.objawy chorób i nie zdaj sobie sprawy, że te choroby mogą zagrażać życiu. Istnieje wiele chorób, które początkowo nie objawiają się w naszym organizmie, ale w końcu okazuje się, że niestety jest już za późno na ich leczenie. Każda choroba ma swoje specyficzne objawy, charakterystyczne zewnętrzne przejawy- tak zwana objawy choroby. Identyfikacja objawów jest pierwszym krokiem w diagnozowaniu chorób w ogóle. Aby to zrobić, wystarczy kilka razy w roku być zbadane przez lekarza nie tylko zapobiegać straszna choroba ale także wsparcie zdrowy umysł w ciele i ciele jako całości.
Jeśli chcesz zadać pytanie lekarzowi, skorzystaj z sekcji konsultacji online, być może znajdziesz tam odpowiedzi na swoje pytania i przeczytasz wskazówki dotyczące samoopieki. Jeśli interesują Cię opinie o klinikach i lekarzach, spróbuj znaleźć potrzebne informacje. Zarejestruj się również na portal medyczny Eurolaboratorium być na bieżąco najnowsze wiadomości oraz aktualizacje informacji na stronie, które będą automatycznie przesyłane do Ciebie pocztą.
Mapa objawów służy wyłącznie do celów edukacyjnych. Nie stosuj samoleczenia; W przypadku wszystkich pytań dotyczących definicji choroby i sposobu jej leczenia, skontaktuj się z lekarzem. EUROLAB nie ponosi odpowiedzialności za konsekwencje spowodowane wykorzystaniem informacji zamieszczonych na portalu.
Jeśli interesują Cię inne objawy chorób i rodzaje zaburzeń lub masz inne pytania i sugestie - napisz do nas, na pewno postaramy się Ci pomóc.

