Восстановление жирового обмена. Нарушение жирового обмена веществ, лечение, симптомы, народные средства
Нарушения липидного обмена могут возникнуть в результате нарушений: 1) всасывания жира в кишечнике; 2) перехода жира из крови в ткань; 3) депонирования жира: 4) межуточного жирового обмена.
§ 198. Нарушение всасывания жира
Для всасывания пищевого жира из кишечника необходимо его эмульгирование, расщепление на глицерин и жирные кислоты и образование комплексных соединений с желчными кислотами - холеинатов. Поэтому прекращение выделения желчи в двенадцатиперстную кишку или уменьшение ее секреции немедленно отражаются на переваривании жиров. Закупорка желчного протока, воспаление желчного пузыря (холецистит) и некоторые заболевания печени, связанные с нарушением процесса секреции желчи, приводят к тому, что неэмульгированные жиры проходят через пищеварительный канал, подвергаясь лишь в незначительной степени гидролизу. Если гидролиз пищевых жиров при этом и осуществляется в достаточной мере под действием липаз панкреатического и кишечного соков, то образующиеся жирные кислоты все же не всасываются. То же происходит при уменьшении или полном прекращении секреции ферментов поджелудочной железы, при понижении функции кишечного эпителия и при значительно усиленной перистальтике тонкого кишечника, когда жир не успевает всосаться. Такого рода расстройства всасывания жира наблюдаются при энтеритах, гиповитаминозах А и В, вследствие нарушения образования ферментов, участвующих в ресинтезе триглицеридов в кишечном эпителии.
Выделение жира происходит в основном через кишечник и в меньшей степени осуществляется сальными и потовыми железами. В моче обнаруживаются лишь следы жира. При нарушениях всасывания жира кал содержит много нерасщепленного жира и высших жирных кислот и имеет характерный серовато-белый цвет - стеаторея. Выделение жира с мочой - липурия - может возникнуть после приема с пищей очень больших количеств жира, при переломах трубчатых костей, сопровождающихся размозжением костного мозга, травме обширных участков жировой ткани, при липоидном нефрозе.
Избыточное выделение жира сальными железами - себорея - имеет место при некоторых заболеваниях кожи - угри, экзема, авитаминозы и др.
Последствия нарушения всасывания жира - хотя жиры и липоиды легко синтезируются в организме из промежуточных продуктов углеводного обмена, полное исключение из пищи жиров недопустимо. С жирами в организм вводятся жизненно необходимые жирорастворимые витамины (A, D, Е, К) и поэтому при недостаточном введении жиров с пищей у человека и животных могут развиваться гиповитаминозы. Кроме того, в состав природных жиров всегда входят в небольшом количестве незаменимые ненасыщенные высшие жирные кислоты (например, линолевая-С 18 Н 32 О 2 и линоленовая - С 18 Н 30 О 2), которые не могут синтезироваться в организме из других жирных кислот. При отсутствии их в пище у животных в эксперименте развиваются хронические заболевания кожи (в виде некротических очагов). По-видимому, полное отсутствие ненасыщенных высших жирных кислот в пище человека также может быть причиной более или менее серьезных расстройств обмена.
§ 199. Нарушение перехода жира из крови в ткани
Поступающий из кишечника нейтральный жир циркулирует в крови в виде хиломикронов (состоящих из триглицеридов, эфиров холестерина, фосфолипидов и β-липопротеида) и α-липопротеидов. В норме содержание нейтральных жиров в крови - 1-2 г/л.
Временное преходящее увеличение содержания хиломикронов в крови - гиперлипемия - наблюдается при повышенном поступлении жира с пищей (алиментарная гиперлипемия ). Гиперлипемия может быть результатом усиления мобилизации жира из депо - транспортная гиперлипемия (рис. 35).
Мобилизации жира из жировых депо, легких, костного мозга способствуют многие гормоны. Например, при голодании выход жира из его депо происходит в результате сочетанного действия СТГ гипофиза, глюкагона поджелудочной железы и адреналина надпочечников. Действие этих гормонов на жировую ткань реализуется через систему аденилциклазы - тАМФ. Последняя повышает активность триглицеридлипазы, осуществляющей липолиз в тканях.
Мобилизация жира из легких, приводящая к гиперлипемии, возникает преимущественно при продолжительной гипервентиляции легких, например у профессиональных певцов.
Ретенционная гиперлипемия (retentio - задерживать) - результат задержки перехода нейтральных жиров из крови в ткани, возникает преимущественно при уменьшении в крови содержания альбумина и фактора просветления (ФП), специфической липопротеидлипазы. Под действием ФП происходит расщепление связанных с протеидами триглицеридов и тем самым "просветление" липемической сыворотки. Образующиеся свободные жирные кислоты связываются альбумином (1 молекула альбумина связывает 6-7 молекул жирных кислот), что способствует переходу жира в клетки. Поэтому недостаток альбумина в крови (например, при голодании, заболеваниях почек - нефрозе) приводит к гиперлипемии, так же как недостаточное содержание ФП и гепарина. Например, при атеросклерозе гиперлипемия зависит от уменьшения содержания гепарина и низкой активности липопротеидлипазы (ФП). При диабете уменьшение в крови ФП зависит от недостатка липокаина.
§ 200. Избыточное накопление жира в жировой ткани
Ожирение является результатом нарушения регуляции поступления жира в жировую ткань, образования его и утилизации как источника энергии.
Одной из существенных причин ожирения является избыточное (по отношению к энергетическим затратам) потребление пищи, связанное с усилением аппетита. Последнее обусловлено повышенной возбудимостью пищевого центра, в частности нервных образований гипоталамической области. Экспериментально установлено, что раздражение вентро-латеральных ядер гипоталамуса и разрушение вентро-медиальных вызывают отсутствие чувства насыщения, усиление аппетита, гиперфагию с последующим отложением жира (так называемое гипоталамическое ожирение).
Клиническим аналогом такого рода ожирения является диэнцефальное ожирение, развивающееся в результате инфекционного и токсического поражения нервных образований в межуточном мозге, а также при опухолях в этой области.
Понижение выхода жира из его депо наступает при подавлении функции щитовидной железы и гипофиза, гормоны которых (тироксин, СТГ, ТТГ) активируют мобилизацию жира и последующее его окисление. Повышенная продукция АКТГ гипофиза, глюкокортикоидов надпочечников и инсулина способствует отложению жира и образованию его из углеводов. Понижение функции половых желез приводит к избыточному отложению жира, если оно сопровождается нарушением деятельности гипоталамических центров (см. §§ 337, 338).
§ 201. Жировая инфильтрация печени
Если подвозимый кровью к клеткам жир не подвергается в них расщеплению и окислению, не выводится и длительное время остается в клетках, возникает жировая инфильтрация (пропитывание). Сочетание ее с нарушением протоплазматической структуры называется - жировая дистрофия.
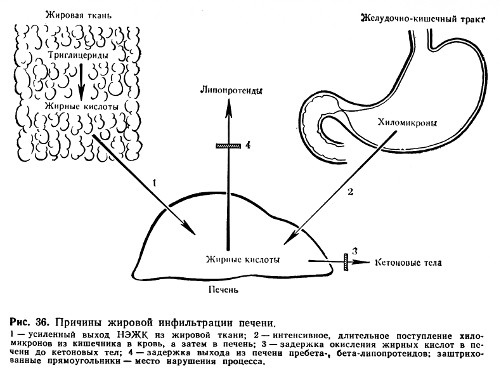
Общей причиной жировой инфильтрации и дистрофии является подавление активности гидролитических и окислительных ферментов жирового обмена (рис. 36), что может наблюдаться при отравлениях фосфором, мышьяком, хлороформом, вирусных инфекциях, авитаминозах (алкоголизме) .
Большое значение в патогенезе жировой инфильтрации печени придается нарушению образования фосфолипидов. Достаточное их содержание в печени обеспечивает тонкое диспергирование жира и тем самым выход его из клетки. В молекуле фосфолипидов катализируется окисление жирных кислот. Недостаточное образование фосфолипидов возникает при дефиците в организме холина, структурной части основного фосфолипида печени - лецитина. А синтез холина в свою очередь связан с метильными группами, донатором которых является аминокислота метионин. Поэтому недостаточное введение в организм пищевого холина или недостаточное образование его из-за недостатка метионина может привести к жировой инфильтрации печени. Метионин, так же как белок казеин, в состав которого входит большое количество метионина, обладает липотропным действием, т. е. способствует удалению из печени избытка жира. Таким же свойством обладает эндогенный липотропный фактор - липокаин (образующийся в эпителии мелких протоков поджелудочной железы). Недостаток липокаина при сахарном диабете способствует жировой инфильтрации печени.
§ 202. Нарушение промежуточного обмена жира
Относительно стабильными продуктами межуточного обмена высших жирных кислот являются ацетон, ацетоуксусная и бета-оксимасляная кислоты, так называемые кетоновые или ацетоновые тела, образующиеся в основном в печени и окисляющиеся до СО 2 и Н 2 О в других тканях и органах (мышцы, легкие, почки и др.). При некоторых патологических процессах и болезнях (сахарный диабет, голодание - полное или исключительно углеводное, длительных инфекциях с высокой температурой, гипоксии, заболеваниях паренхимы печени и др.) содержание ацетоновых тел в крови может резко повыситься (в норме их содержание не превышает 0,02-0,04 г/л) (2-4 мг%). Ацетонемия приводит к появлению кетоновых и ацетоновых тел в моче - ацетурии. Ацетон выделяется не только через почки, но и через легкие с выдыхаемыми газами и с потом. От больного при этом пахнет ацетоном.
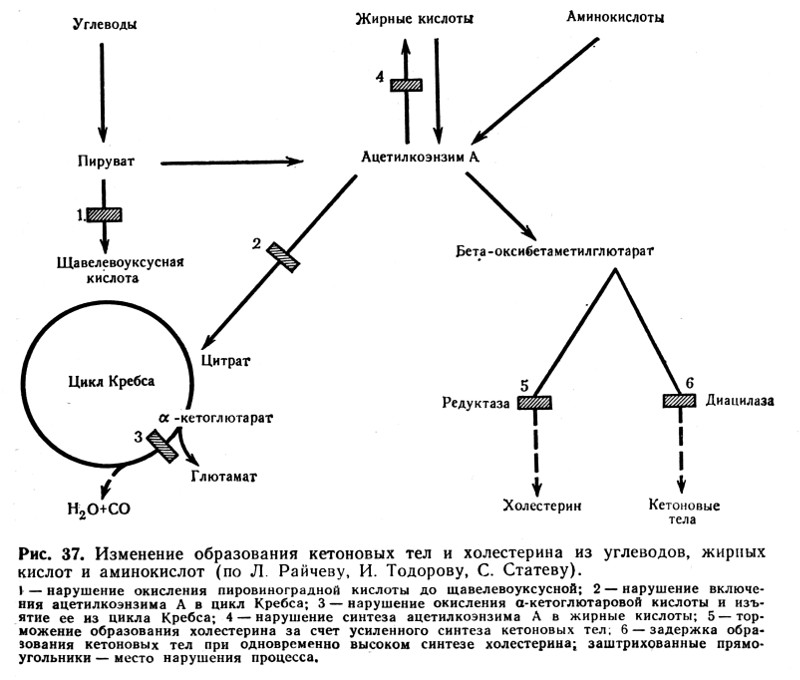
Механизмы, приводящие к увеличению кетоновых тел в крови (кетозу), достаточно сложны.
- Одной из основных причин развития кетоза является дефицит углеводов (например, при сахарном диабете, голодании), который приводит к обеднению печени гликогеном и усиленному поступлению в нее жира, где и происходит окисление жирных кислот до ацетоуксусной кислоты. Этому способствует также недостаточный ресинтез высших жирных кислот из кетоновых тел и нарушение окисления их в трикарбоновом (лимонном) цикле. Для ресинтеза необходима энергия гликолиза. Недостаточное окисление кетоновых тел связано также с дефицитом соединений, образующихся при промежуточном обмене углеводов (пировиноградная и щавелевоуксусная кислоты) и являющихся субстратами цикла трикарбоновых кислот (рис. 37).
- Важным патогенетическим звеном в развитии кетоза при сахарном диабете является одновременная недостаточность липокаина и инсулина.
- При поражении печени, вызванном токсино-инфекционными факторами, нарушена гликогенобразовательная функция печени, что способствует переходу в печень жирных кислот. Здесь образование кетоновых тел в значительной степени превалирует над их окислением. В результате возникает кетоз и жировая инфильтрация печени.
§ 203. Нарушение обмена фосфолипидов
Нарушения обмена фосфолипидов (лецитинов, кефалинов) тесно связаны с жировым обменом. Так при липемии повышается уровень лецитина в крови.
Известны некоторые наследственно обусловленные патологические состояния, связанные с избыточным отложением в тканях фосфолипидов. Например, при болезни Гоше цереброзиды откладываются в макрофагальных клетках селезенки, печени, лимфатических узлов и костного мозга. При болезни Нимана-Пика в клетках различных органов наблюдается отложение фосфатида сфингомиелина. Амавротическая (от греч. amauros - темный, слепой) семейная идиотия является результатом отложения липоидов в нервных клетках, что сопровождается атрофией зрительных нервов и слабоумием.
§ 204. Нарушения обмена холестерина. Атеросклероз
Нарушения холестеринового обмена лежат в основе развития атеросклероза, желчнокаменной болезни, липоидного нефроза, возрастного помутнения роговицы, ксантоматоза кожи, костей и других заболеваний.
В изучении нарушений холестеринового обмена большую роль сыграли русские патофизиологи Н. П. Аничков и С. С. Халатов. Еще в 1911-1912 гг. ими была создана экспериментальная модель атеросклероза путем скармливания животным холестерина. Хотя в патогенезе атеросклероза человека значение экзогенного (поступающего с пищей холестерина) не столь существенно, но факт нарушения обмена холестерина при этом не вызывает сомнения.
В физиологических условиях содержание холестерина в крови взрослого человека составляет около 1,8-2,3 г/л. Некоторое повышение уровня холестерина в крови может наступить после приема богатой холестерином пищи (яичный желток, мозг, печень, сливочное масло и др.), но эта алиментарная гиперхолестеринемия у человека быстропроходяща, ибо при избытке холестерина из тучных клеток в кровь высвобождается гепарин, активирующий липопротеидлипазу, так называемый "фактор просветления" (ФП). Последняя переводит крупномолекулярные липиды с низкой плотностью в мелкодисперсные, легко выводимые из крови.
Изменения холестеринового обмена могут быть результатом нарушения синтеза холестерина, приводящего к эндогенной гиперхолестеринемии. Синтез холестерина регулируется прежде всего его поступлением из кишечника: незначительное поступление активирует синтез холестерина. Исходным материалом для синтеза холестерина служат, помимо ацетоуксусной кислоты, аминокислоты валин и лейцин, жирные кислоты, углеводы, которые в процессе межуточного обмена превращаются в ацетилкоэнзим А. Последний включается в цикл бета-окси-бета-метил-глютарилкоэнзим А и способствует развитию гиперхолестеринемии.
Важным фактором холестеринового обмена является активность тканевых ферментов, обеспечивающих расщепление липидов. Так, доказано, что при патологических состояниях, предрасполагающих к атеросклерозу (диабет, стресс, гипоксия), липолитическая активность стенки аорты значительно понижается, а содержание холестерина в ней резко возрастает. В стенке аорты здоровых людей содержится 5-50 мг холестерина, в атероматозной аорте - 240 мг, при тяжелых формах атероматоза содержание холестерина в аорте может достигать 500-1000 мг.
Причиной гиперхолестеринемии может быть и изменение физико-химического состояния белков крови, благодаря чему образуется более прочная связь холестерина с β-липопротеидами и затрудняется освобождение из комплекса холестерина, или, наоборот, происходит разрыв β-протеидного комплекса и уменьшается дисперсность холестериновых мицелл. И в том, и в другом случае холестерин задерживается в крови.
В нарушении холестеринового обмена имеет значение выпадение функции щитовидной, половых желез, надпочечников. Какие звенья холестеринового обмена меняет каждый из этих гормонов, вопрос очень сложный. Они могут менять скорость переноса холестерина в клетку и из клетки, влиять на распределение его фракций между плазмой крови и интерстициальной жидкостью, на процессы синтеза и распада холестерина.
Наиболее важным проявлением нарушения обмена холестерина в организме человека является атеросклероз.
Липиды - неоднородные по химическому составу органические вещества, нерастворимые в воде, но растворимые в неполярных растворителях.
Типовыми формами патологии липидного обмена являются ожирение, истощение, липодистрофии, липидозы и дислипопротеинемии.
Ожирение
Ожирение - избыточное накопление липидов в организме в виде триглицеридов.
ВИДЫ ОЖИРЕНИЯ
В зависимости от степени увеличения массы тела выделяют три степени ожирения.
Для оценки оптимальной массы тела используют различные формулы.
♦ Наиболее простая - индекс Брока: из показателя роста (в см) вычитают 100.
♦ Индекс массы тела (ИМТ) вычисляют также по следующей формуле:
В зависимости от значения индекса массы тела говорят о нормальной или избыточной массе тела 3 степеней (табл. 10-1).
По преимущественной локализации жировой ткани различают ожирение общее (равномерное) и местное (локальная липогипертрофия). Различают две разновидности местного ожирения.
♦ Женский тип (гиноидный) - избыток подкожного жира преимущественно в области бёдер и ягодиц.
Таблица 10-1. Степени ожирения
 ♦ Мужской тип (андроидный или абдоминальный) - накопление жира преимущественно в области живота.
♦ Мужской тип (андроидный или абдоминальный) - накопление жира преимущественно в области живота.
По генезу выделяют первичное ожирение и вторичные его формы.
♦ Первичное (гипоталамическое) ожирение - самостоятельное заболевание нейроэндокринного генеза, обусловленное расстройством системы регуляции жирового обмена.
♦ Вторичное (симптоматическое) ожирение - следствие различных нарушений в организме, обусловливающих снижение липолиза и активацию липогенеза (например, при СД, гипотиреозе, гиперкортицизме).
ЭТИОЛОГИЯ
Причина первичного ожирения - нарушение функционирования системы «гипоталамус-адипоциты».
Вторичное ожирение развивается при избыточной калорийности пищи и пониженном уровне энергозатрат организма (в основном при гиподинамии).
ПАТОГЕНЕЗ ОЖИРЕНИЯ
Выделяют нейрогенные, эндокринные и метаболические механизмы ожирения.
Нейрогенные варианты ожирения
Центрогенный (корковый, психогенный) механизм - один из вариантов расстройства пищевого поведения (два других: неврогенная анорексия и булимия).
♦ Причина: различные расстройства психики, проявляющиеся постоянным, иногда непреодолимым стремлением к приёму пищи.
♦ Возможные механизмы:
❖ активация серотонинергической, опиоидергической и других систем, участвующих в формировании ощущений удовольствия и комфорта;
❖ восприятие пищи как сильного положительного стимула (допинга), что ещё более активирует указанные системы. Это
замыкает порочный круг центрогенного механизма развития ожирения.
Гипоталамический (диэнцефальный, подкорковый) механизм.
♦ Причина: повреждение нейронов гипоталамуса (например, после сотрясения мозга, при энцефалитах, краниофарингиоме, метастазах опухолей в гипоталамус).
♦ Наиболее важные звенья патогенеза:
❖ Повреждение или раздражение нейронов заднелатерального вентрального ядра гипоталамуса стимулирует синтез и секрецию нейропептида Y и снижает чувствительность к лептину, ингибирующему синтез нейропептида Y. Нейропептид Y стимулирует чувство голода и повышает аппетит.
❖ Нарушение формирования чувства голода вследствие избыточной выработки нейромедиаторов, формирующих чувство голода и повышающих аппетит (ГАМК, дофамина, β-эндорфина, энкефалинов). Это приводит к снижению синтеза нейромедиаторов, формирующих чувство сытости и угнетающих пищевое поведение (серотонина, норадреналина, холецистокинина, соматостатина).
Эндокринные варианты ожирения
Эндокринные механизмы ожирения - лептиновый, гипотиреоидный, надпочечниковый и инсулиновый.
Лептиновый механизм - ведущий в развитии первичного ожирения.
♦ Лептин образуется в жировых клетках. Он уменьшает аппетит и повышает расход энергии организмом. Лептин подавляет образование и выделение гипоталамусом нейропептида Y.
♦ Нейропептид Y участвует в формировании чувства голода. Он повышает аппетит и снижает энергорасходы организма.
♦ Липостат. Контур «лептин-нейропептид Y» обеспечивает поддержание массы жировой ткани тела при участии инсулина, катехоламинов, серотонина, холецистокинина, эндорфинов. В целом, эта система БАВ, обеспечивающих динамический гомеостаз энергетического обмена и массы жировой ткани в организме, получила название системы липостата.
Гипотиреоидный механизм ожирения включается при недостаточности эффектов йодсодержащих гормонов щитовидной железы, что снижает интенсивность липолиза, скорость обменных процессов в тканях и энергетические затраты организма.
Надпочечниковый (глюкокортикоидный, кортизоловый) механизм ожирения включается вследствие гиперпродукции глюкокортикоидов в коре надпочечников (например, при болезни и синдроме
Иценко-Кушинга), что способствует липогенезу за счёт гипергликемии и включения инсулинового механизма.
Инсулиновый механизм развития ожирения развивается вследствие прямой активации инсулином липогенеза в жировой ткани.
Метаболические механизмы ожирения. Запасы углеводов в организме относительно малы. В связи с этим выработался механизм экономии углеводов: при повышении в рационе доли жиров скорость окисления углеводов снижается. При расстройстве системы регуляции активируется механизм, обеспечивающий повышение аппетита и увеличение приёма пищи. В этих условиях жиры не подвергаются расщеплению и накапливаются в виде триглицеридов.
Истощение
Истощение - патологическое снижение массы жировой, а также мышечной и соединительной ткани ниже нормы. Крайней степенью истощения является кахексия.
При истощении дефицит жировой ткани составляет более 20-25%, а при кахексии - более 50%. ИМТ при истощении менее 19,5 кг/м 2 .
ЭТИОЛОГИЯ
Истощение может быть вызвано эндогенными и экзогенными причинами.
Экзогенные причины:
♦ Вынужденное или осознанное полное либо частичное голодание.
♦ Недостаточная калорийность пищи.
Эндогенные причины истощения подразделяют на первичные и вторичные.
♦ Причина первичного истощения: подавление синтеза нейропептида Y в гипоталамусе (при травме или ишемии гипоталамуса, сильном затяжном стрессе) и гипосенситизация клеток-мишеней к нейропептиду Y.
♦ Причины вторичного (симптоматического) истощения: мальабсорбция, дефицит глюкокортикоидов, гипоинсулинизм, повышенный синтез глюкагона и соматостатина, гиперпродукция клетками опухолей ФНОα.
ПАТОГЕНЕЗ
Экзогенное истощение и кахексия. Отсутствие или значительный дефицит продуктов питания приводят к истощению запаса жиров, нарушению всех видов обмена веществ, недостаточности биологического окисления и подавлению пластических процессов.
Первичные эндогенные формы истощения
Наибольшее клиническое значение имеют гипоталамическая, кахектиновая и анорексическая формы.
При гипоталамической (диэнцефальной, подкорковой) форме истощения и кахексии происходит снижение или прекращение синтеза и выделения в кровь нейронами гипоталамуса пептида Y, что нарушает липостат.
При кахектиновой (или цитокиновой) форме истощения синтез адипоцитами и макрофагами ФНОа (кахектина) приводит к подавлению синтеза нейропептида Y в гипоталамусе, угнетению липогенеза и активации катаболизма липидов.
Анорексическая форма.
♦ У лиц, имеющих предрасположенность к анорексии, критическое отношение к массе своего тела (воспринимаемой как избыточную) приводит к развитию нервно-психических расстройств и длительным периодам отказа от приёма пищи. Наиболее часто наблюдается у девочек-подростков и девушек до 18-летнего возраста.
♦ Дальнейшее течение процесса связано с уменьшением синтеза нейропептида Y и значительным снижением массы тела, вплоть до кахексии.
Вторичные эндогенные формы истощения и кахексии являются симптомами других форм патологии: синдромов мальабсорбции, роста новообразований (синтезирующих ФНОа), гипоинсулинизма, гипокортицизма, недостатка эффектов гормонов вилочковой железы.
Липодистрофии и липидозы
Липодистрофии - состояния, характеризующиеся генерализованной или локальной утратой жировой ткани, реже - избыточным её накоплением в подкожной клетчатке.
Липидозы - состояния, характеризующиеся расстройствами метаболизма липидов в клетках (паренхиматозные липидозы), жировой клетчатке (ожирение, истощение) или стенках артериальных сосудов (например, при атеросклерозе).
Дислипопротеинемии
Дислипопротеинемии - состояния, характеризующиеся отклонением от нормы содержания, структуры и соотношения в крови различных ЛП.
Характер течения и клинические проявления дислипопротеинемий определяются:
♦ генетическими особенностями организма (например, составом, соотношением и уровнем различных ЛП);
♦ факторами внешней среды (например, набором продуктов питания, особенностями рациона и режима приёма пищи);
♦ наличием сопутствующих заболеваний (например, ожирения, гипотиреоза, СД, поражений почек и печени).
Атерогенность липопротеинов
ЛП подразделяют на атерогенные (ЛПОНП, ЛПНП и ЛППП) и антиатерогенные (ЛПВП).
Оценку потенциальной атерогенности ЛП крови проводят путём расчёта холестеринового коэффициента атерогенности:
холестерин общий - холестерин ЛПВП
холестерин ЛПВП
В норме холестериновый коэффициент атерогенности не превышает 3,0. При увеличении этого значения риск развития атеросклероза нарастает.
ВИДЫ ДИСЛИПОПРОТЕИНЕМИЙ
По происхождению: первичные (наследственные; они могут быть моногенными и полигенными) и вторичные.
По изменению содержания липопротеинов в крови: гиперлипопротеинемии, гипо- и алипопротеинемии, комбинированные дислипопротеинемии.
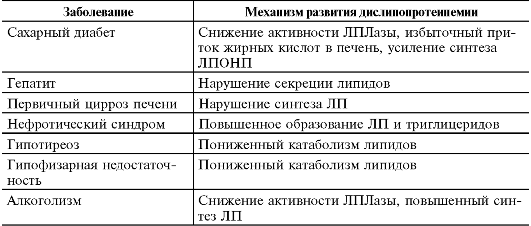
К развитию вторичных дислипопротеинемий могут приводить различные, как правило, хронические заболевания (табл. 10-2).
Таблица 10-2. Заболевания, приводящие к развитию вторичных дислипопротеинемий
 Гиперлипопротеинемии
Гиперлипопротеинемии
Гиперлипопротеинемии - состояния, проявляющиеся стойким повышением содержания ЛП в плазме крови.
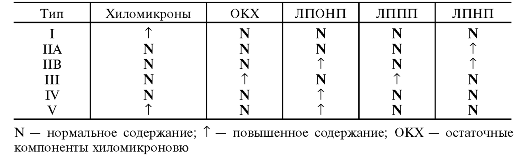
В 1967 г. Фредриксон и соавт. разработали классификацию гиперлипопротеинемий. Позднее эта классификация была пересмотрена специалистами ВОЗ (табл. 10-3).
Таблица 10-3. Типы гиперлипопротеинемий и содержание различных липопротеинов при них
 Гиполипопротеинемии
Гиполипопротеинемии
Гиполипопротеинемии - состояния, проявляющиеся стойким снижением уровня ЛП в плазме крови вплоть до полного их отсутствия (алипопротеинемия).
Комбинированные дислипопротеинемии характеризуются нарушением соотношения различных фракций ЛП.
Атеросклероз
Атеросклероз - хронический патологический процесс, приводящий к изменениям преимущественно во внутренней оболочке артерий эластического и мышечно-эластического типов вследствие накопления избытка липидов, образования фиброзной ткани, а также комплекса других изменений в них.
При атеросклерозе наиболее часто поражаются такие артерии, как коронарные, сонные, почечные, брыжеечные, нижних конечностей, а также брюшной отдел аорты.
ЭТИОЛОГИЯ
Причины атеросклероза окончательно не выяснены. Существует три гипотезы, объясняющие возникновение атеросклероза: липидная, хронического повреждения эндотелия и моноклональная.
Факторы риска. Известно не менее 250 факторов, способствующих возникновению и развитию атеросклероза. К наиболее значимым факторам риска относят курение, сахарный диабет, артериальную гипертензию, ожирение, аутоиммунные заболевания, гиперхолестеринемию, гипертриглицеридемию, гипергомоцистеинемию, гиподинамию, наследственную предрасположенность, приём пероральных контрацептивов.
ПАТОГЕНЕЗ
Выделяют следующие стадии атеросклеротического поражения сосудов: липидных пятен и полосок, образования атеромы и фиброатеромы, развития осложнений (рис. 10-1).
Липидные пятна и полоски
Неповреждённый эндотелий препятствует проникновению ЛП в интиму артерий. Под воздействием факторов риска эндотелиальные клетки повреждаются, и развивается эндотелиальная дисфункция - пусковой фактор атерогенеза.
Образование липидных пятен и полосок протекает в несколько этапов:
♦ Миграции в участки интимы артерий с повреждёнными эндотелиальными клетками большого числа моноцитов и Т-лимфоцитов.
♦ Синтеза лейкоцитами БАВ (факторов хемотаксиса, кининов, Пг, ФНОа) и активных форм кислорода, что сопровождается интенсификацией СПОЛ. Указанные факторы потенцируют повреждение эндотелия и проникновение ЛП в интиму сосудов.
♦ Дополнительной активации перекисного окисления проникающих в субэндотелиальный слой ЛПНП с образованием модифицированных ЛП.
♦ Захвата модифицированных ЛП моноцитами при помощи «скевенджер-рецепторов» (рецепторов-чистильщиков) и превращение их в пенистые клетки - макрофаги, насыщенные липидами.
♦ Активации в очаге повреждения стенки артерии Т-лимфоцитов и макрофагов с развитием асептического воспаления.
♦ Пролиферации ГМК и фибробластов и синтеза ими компонентов соединительной ткани с образованием в интиме липидных пятен и полосок.
Формирование атеромы и фиброатеромы
Формирование атеросклеротической бляшки обусловлено несколькими факторами:
Дальнейшим повреждением эндотелия медиаторами воспаления, что потенцирует проникновение в интиму сосудов ЛПНП и замыканию порочного круга.
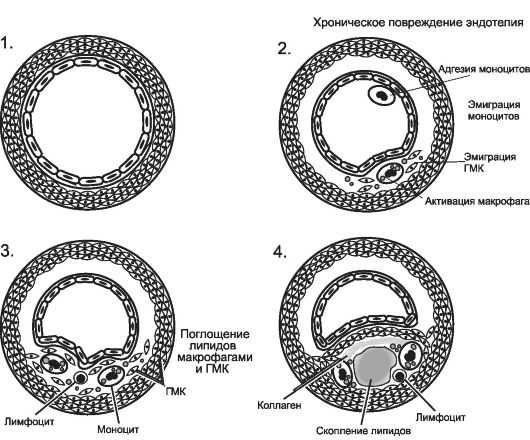 Рис. 10-1.
Последовательные
изменения в повреждённой артериальной стенке при атеросклерозе. 1 -
нормальная стенка артерии; 2 - адгезия моноцитов и тромбоцитов к
повреждённому эндотелию; 3 - миграция моноцитов и ГМК в интиму, липидная
инфильтрация; 4 - пролиферация клеточных элементов, формирование
липидного ядра и образование фиброатеромы. [по 4].
Рис. 10-1.
Последовательные
изменения в повреждённой артериальной стенке при атеросклерозе. 1 -
нормальная стенка артерии; 2 - адгезия моноцитов и тромбоцитов к
повреждённому эндотелию; 3 - миграция моноцитов и ГМК в интиму, липидная
инфильтрация; 4 - пролиферация клеточных элементов, формирование
липидного ядра и образование фиброатеромы. [по 4].
Трансформацией ГМК в макрофагоподобные и активацией синтеза ими и фибробластами компонентов межклеточного вещества соединительной ткани (протеогликанов, гликозаминогликанов, коллагеновых и эластических волокон).
Формированием липидного ядра атеромы в связи с гибелью пенистых клеток и выходом из них свободных липидов.
♦ Атерома характеризуется наличием значительного количества клеточных элементов: пенистых клеток, ГМК на разных этапах пролиферации и трансформации, лимфоцитов, гранулоцитов, тромбоцитов; формированием липидного ядра с большим количеством свободного холестерина и его эфиров.
♦ Фиброатерома характеризуется формированием фиброзной крышки над липидным ядром за счёт синтеза компонентов соединительной ткани и развитием сети новообразованных сосудов, проникающих в бляшку.
Развитие осложнений атеросклероза
Модификация атеросклеротических бляшек приводит к развитию следующих процессов:
♦ кальцификаций, атерокальцинозу - накоплению в ткани бляшек соединений кальция;
♦ трещинам крышки фиброатеромы или её изъязвлениям, что сопровождается развитием пристеночного тромба с угрозой обтурации артерии или её эмболии;
♦ разрывам стенок новообразованных микрососудов, приводящим к кровоизлияниям в стенку артерии, образованию пристеночных и интрамуральных тромбов.
Клинически осложнения атеросклероза наиболее часто проявляются ишемией и инфарктами органов и тканей, снабжаемых кровью из по- ражённой артерии.
ПРИНЦИПЫ ПРОФИЛАКТИКИ И ТЕРАПИИ АТЕРОСКЛЕРОЗА
Этиотропный. Имеет целью исключение или ослабление действия факторов риска. Примеры мероприятий: применение гиполипидемических ЛС, коррекция АД, отказ от курения, соблюдение опре- делённой диеты.
Патогенетический. Направлен на разрыв «цепочки атерогенеза». Примеры воздействий: использование антиагрегантов и антикоагулянтов; применение специфических ЛС, уменьшающих воспаление в атероме (например, статинов или моноклональных антител к ФНОа и другим провоспалительным цитокинам).
Под термином «обмен веществ» подразумевают все химические реакции, которые протекают в организме. Без них жизнедеятельность человеческого тела становится невозможной, ведь только благодаря таким процессам клеточки существуют: растут, контактируют с окружающим миром, питаются и очищаются. Существует довольно много видов обмена, в них принимают участие белки, жиры, а также аминокислоты. И в некоторых случаях течение таких процессов может нарушаться, что требует соответствующей коррекции. Давайте поговорим на www.сайт о том, что собой представляет нарушение жирового обмена веществ, рассмотрим его лечение и симптомы, а также народные средства которые помогут справиться с такой проблемой.
Под термином «жировой обмен» подразумевают выработку и расщепление жиров (липидов) внутри организма. Процессы расщепления жиров осуществляются большей частью в печени, а также в жировой ткани. А сбои в нормальном обмене липидов могут стать причиной развития атеросклероза, ожирения, а также разных эндокринных болезней (к примеру, сахарного диабета). Как известно, жировой обмен характеризуется особенно сложной регуляцией. На нее влияют инсулин, половые гормоны, а также адреналин, тироксин и прочие гормоны.
О том как проявляется нарушение жирового обмена, симптомы какие указывают на болезнь
Жировой обмен происходит практически во всех клеточках и тканях организма. Как раз по этой причине симптомы его нарушений с трудом поддаются локализации, и их сложно разделить на первичные либо на вторичные.
Самый основной и заметный признак расстройства – заметное увеличение объемов подкожной жировой клетчатки, которая является основным депо жира в теле. В том случае, если процесс такого накопления происходит с особенной интенсивностью, доктора поднимают вопрос об ожирении и рассматривают его, как самостоятельную болезнь. Ожирение само по себе дает о себе знать рядом неприятных симптомов. Такое нарушение становится причиной уменьшения физических возможностей, провоцирует одышку, храп и пр. Пациенты с такой проблемой испытывают постоянный голод, ведь разросшиеся жировые ткани требуют питания.
Ожирение может стать причиной болезней сердца, появления обструктивного апноэ, бесплодия и сахарного диабета.
Нарушение жирового обмена в организме сопровождается накоплением жира не только в подкожной клетчатке, но и в крови. В результате таких патологических процессов у человека развивается гиперлипидемия. В этом случае анализы крови больного показывают увеличение концентрации холестерина, уровня триглицеридов, а также липопротеинов низкой плотности в плазме.
Ожирение крови является столь же опасным, как и скопление жиров под кожей. При повышении количества липидов в крови их частицы активно проникают внутрь стенок артерий. После они откладываются на поверхности сосудов, давая тем самым начало бляшкам атеросклероза. Такие формирования постепенно растут и могут стать причиной закупорки просвета сосудов. В определенных случаях у больного может случиться полное прекращение кровотока – инфаркт либо инсульт.
Стоит отметить, что иногда нарушение жирового обмена проявляется недостатком липидов. В этом случае у больного начинается истощение, у него фиксируется нехватка жирорастворимых витаминов А,D, Е и К. Также возникает сбой менструального цикла и репродуктивных функций. Кроме того дефицит липидов вызывает нехватку незаменимых ненасыщенных жирных кислот, что дает о себе знать выпадением волос, возникновением экземы, воспалительными поражениями кожи и поражениями почек.
О том как корректируется нарушение жирового обмена, лечение какое помогает
Пациентам с нарушениями обмена веществ показано устранение факторов риска, кроме того им необходимо диетическое питание. Иногда только этих средств консервативной коррекции достаточно для оптимизации состояния больного. Однако человеку с нарушением обменных процессов чаще всего приходится соблюдать ограничения рациона питания на протяжении всей жизни.
В меню таких пациентов должно находиться значительное количество овощей, фруктов, а также злаков и нежирных молочных продуктов. Физические нагрузки подбираются в индивидуальном порядке, кроме того больным нужно отказаться от курения, потребления алкоголя и беречься от стрессов.
Если такие меры не дают положительного эффекта, доктора подключают медикаментозную терапию. При этом могут применяться статины, никотиновая кислота и ее производные, препаратами выбора иногда становятся фибраты, антиоксиданты и секвестранты желчных кислот. Лекарства могут подбираться лишь доктором, равно как и их дозировка.
Лечение нарушения жирового обмена народными средствами
Для терапии нарушений обменных процессов могут применяться лекарства на основе трав. Так неплохой эффект дает прием настоя иван-чая. Тридцать грамм такого сырья заварите полулитром кипятка, доведите лекарство до кипения и настаивайте в течение получаса. Принимайте полученный состав по семьдесят миллилитров четырежды на день.
Также вы можете заварить сорок грамм листиков подорожника двумястами миллилитрами кипятка. Настаивайте укутанным в течение получаса, после процедите и принимайте по тридцать миллилитров примерно за двадцать минут до трапезы трижды на день.
Еще вы можете соединить пятнадцать грамм хвоща с двумястами миллилитрами кипятка. Настаивайте укутанным полчаса, после процедите. Принимайте по пятьдесят миллилитров четырежды в день.
При подозрении на развитие нарушений обменных процессов стоит обращаться за докторской помощью.
Нарушения липидного обмена
Липиды - разнородные по химическому составу вещества. В организме человека имеются разнообразные липиды: жирные кислоты, фосфолипиды, холестерин, триглицериды, стероиды и др. Потребность человека в жирах колеблется в диапазоне 80-100 г в сутки.
Функции липидов
Структурная: Липиды составляют основу клеточных мембран.
Регуляторная.
† Липиды регулируют проницаемость мембран, их коллоидное состояние и текучесть, активность липидозависимых ферментов (например, аденилат‑ и гуанилатциклаз, Na + ,K + ‑АТФазы, Ca 2+ ‑АТФазы, цитохромоксидазы), активность мембранных рецепторов (например, для катехоламинов, ацетилхолина, инсулина, цитокинов).
† Отдельные липиды - БАВ (например, Пг, лейкотриены, фактор активации тромбоцитов, стероидные гормоны) - регулируют функции клеток, органов и тканей.
Энергообеспечивающая. Липиды являются одним из главных источников энергии для поперечнополосатой мускулатуры, печени, почек и дополнительным источником энергии для нервной ткани.
Защитная. В составе подкожной клетчатки липиды образуют буферный
слой, защищающий мягкие ткани от механических воздействий.
Изолирующая. Липиды создают термоизолирующую прослойку в поверхностных тканях организма и электроизолирующую оболочку вокруг нервных волокон.
Типовые формы патологии
Типовые формы патологии липидного обмена представлены на рис. 10–1.
Рис. 10–1. Типовые формы патологии липидного обмена.
В зависимости от уровня нарушений метаболизма липидов выделяют расстройства:
† Переваривания и всасывания липидов в ЖКТ (например, в результате дефицита липаз поджелудочной железы, нарушения желчеобразования и желчевыделения, расстройств полостного и «мембранного» пищеварения).
† Трансмембранного переноса липидов из кишечника в кровь и утилизации их клетками (например, при энтеритах, нарушении кровообращения в стенке тонкого кишечника).
† Метаболизма липидов в тканях (например, при дефекте или недостаточности липаз, фосфолипаз, ЛПЛазы).
В зависимости от клинических проявлений различают ожирение, истощение, дислипопротеинемии, липодистрофии и липидозы.
Ожирение
Нормальное содержание жировой ткани у мужчин составляет 15–20% массы тела, у женщин - 20–30%.
Ожирение - избыточное (патологическое) накопление жира в организме в виде триглицеридов. При этом масса тела увеличивается более чем на 20–30%.
По данным экспертов ВОЗ, в развитых странах Европы избыточную массу тела имеют от 20 до 60% населения, в России - около 60%.
Само по себе увеличение массы жировой ткани не представляет опасности для организма, хотя и снижает его адаптивные возможности. Однако, ожирение увеличивает риск возникновения ИБС (в 1,5 раза), атеросклероза (в 2 раза), гипертонической болезни (в 3 раза), СД (в 4 раза), а также некоторых новообразований (например, рака молочной железы, эндометрия и простаты).
Виды ожирения
Основные виды ожирения приведена на рис. 10–2.
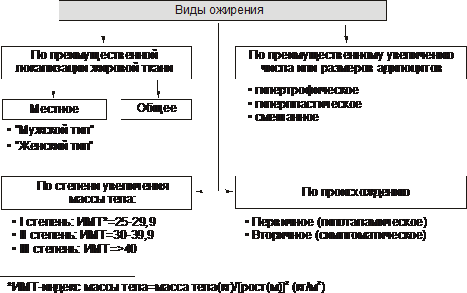
Рис. 10–2. Виды ожирения . ИМТ - индекс массы тела (см. в тексте).
В зависимости от степени увеличения массы тела выделяют три степени ожирения. При этом применяют понятие «идеальная масса тела».
Для оценки идеальной массы тела используют различные формулы.
† Наиболее простая - индекс Брока : из показателя роста (в см) вычитают 100.
† Индекс массы тела вычисляют также по следующей формуле:
Масса тела считается нормальной при индексе массы тела в диапазоне 18,5–24,9. При превышении этих значений говорят об избыточной массе тела (табл. 10–1).
Таблица 10–1. Степени ожирения
Примечание. ИМТ - индекс массы тела
По преимущественной локализации жировой ткани различают ожирение общее (равномерное) и местное (локальная липогипертрофия). Разновидности местного ожирения:
† Женский тип (гиноидный) - избыток подкожного жира преимущественно в области бёдер и ягодиц.
† Мужской тип (андроидный) - накопление жира в области живота.
По преимущественному увеличению числа или размеров жировых клеток выделяют:
† Гиперпластическое ожирение (за счёт преимущественного увеличения числа адипоцитов). Оно более устойчиво к лечению и в тяжёлых случаях требует хирургического вмешательства по удалению избытка жира.
† Гипертрофическое (за счёт преимущественного увеличения массы и размеров адипоцитов). Оно чаще наблюдается после 30 лет.
† Гиперпластическо‑гипертрофическое (смешанное). Нередко выявляется и в детском возрасте.
По генезу выделяют первичное ожирение и вторичные его формы.
† Первичное (гипоталамическое) ожирение - результат расстройств системы регуляции жирового обмена (липостата) -самостоятельное заболевание нейроэндокринного генеза.
† Вторичное (симптоматическое) ожирение - следствие различных нарушений в организме, обусловливающих:
‡ снижение энергозатрат (и следовательно - расхода триглицеридов жировой ткани),
‡ активацию синтеза липидов - липогенеза (наблюдается при ряде заболеваний, например, при СД, гипотиреозе, гиперкортицизме).
Причины ожирения
Причина первичного ожирения - нарушение функционирования системы «адипоциты - гипоталамус». Это является результатом дефицита и/или недостаточности эффектов лептина (по подавлению выработки нейронами гипоталамуса нейропептида Y, который повышает аппетит и чувство голода).
Вторичное ожирение развивается при избыточной калорийности пищи и п ониженном уровне энергозатрат организма. Энергозатраты зависят от степени активности (прежде всего физической) и образа жизни человека. Недостаточная физическая активность является одной из важных причин ожирения.
Патогенез ожирения
Выделяют нейрогенные, эндокринные и метаболические механизмы возникновения ожирения.
Нейрогенные варианты ожирения
Нейрогенные (центрогенный и гипоталамический) механизмы ожирения представлены на рис. 10–3.
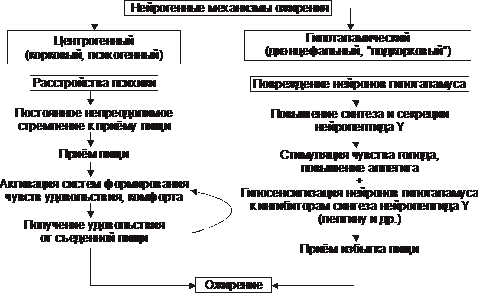
Рис. 10–3. Нейрогенные механизмы ожирения.
† Центрогенный (корковый, психогенный) механизм - один из вариантов расстройства пищевого поведения (два других: неврогенная анорексия и булимия). Причина: различные расстройства психики, проявляющиеся постоянным, иногда непреодолимым стремлением к приёму пищи. Возможные механизмы:
‡ активация серотонинергической, дофаминергической, опиоидергической и других систем, участвующих в формировании ощущений удовольствия и комфорта;
‡ восприятие пищи как сильного положительного стимула (допинга), что ещё более активирует указанные системы - замыкается порочный круг центрогенного механизма развития ожирения.
† Гипоталамический (диэнцефальный, подкорковый) механизм. Его причина - повреждение нейронов вентромедиального и паравентрикулярного ядер гипоталамуса (например, после сотрясения мозга, при энцефалитах, краниофарингиоме, метастазах опухолей в гипоталамус). Наиболее важные звенья патогенеза:
‡ Спонтанное (без выясненной причины) повышение синтеза и секреции нейропептида Y нейронами заднелатерального вентрального ядра гипоталамуса.
‡ Повреждение или раздражение нейронов вышеназванного ядра также стимулирует синтез и секрецию нейропептида Y и снижает чувствительность к факторам, ингибирующим синтез нейропептида Y (главным образом - к лептину).
§ Нейропептид Y стимулирует чувство голода и повышает аппетит.
§ Лептин подавляет образование стимулятора аппетита - нейропептида Y.
‡ Нарушение участия гипоталамуса в формировании чувства голода. Это чувство формируется при снижении ГПК, сокращении мышц желудка при эвакуации пищи и его опорожнении (чувство пищевого дискомфорта - «сосёт под ложечкой»). Информация от периферических чувствительных нервных окончаний интегрируется в нервных ядрах гипоталамуса, ответственных за пищевое поведение.
‡ В результате вышеназванных процессов усиливается выработка нейромедиаторов и нейропептидов, формирующих чувство голода и повышающих аппетит (ГАМК, дофамина, - эндорфина, энкефалинов) и/или нейромедиаторов и нейропептидов, формирующих чувство сытости и угнетающих пищевое поведение (серотонина, норадреналина, холецистокинина, соматостатина).
Эндокринные варианты ожирения
Эндокринные механизмы ожирения - лептиновый, гипотиреоидный, надпочечниковый и инсулиновый - представлены на рис. 10–4.
![]()
Рис. 10–4. Патогенез ожирения.
† Лептиновый механизм - ведущий в развитии первичного ожирения.
‡ Лептин образуется в жировых клетках. Он уменьшает аппетит и повышает расход энергии организмом. Уровень лептина в крови прямо коррелирует с количеством белой жировой ткани. Рецепторы к лептину имеют многие клетки, в том числе - нейроны вентромедиального ядра гипоталамуса. Лептин подавляет образование и выделение гипоталамусом нейропептида Y.
‡ Нейропептид Y формирует чувство голода, повышает аппетит, снижает энергорасходы организма. Между гипоталамусом и жировой тканью существует своего рода отрицательная обратная связь: избыточное потребление пищи, сопровождающееся увеличением массы жировой ткани, приводит к усилению секреции лептина. Это (посредством торможения выработки нейропептида Y) ослабляет чувство голода. Однако, у тучных людей этот регуляторный механизм может быть нарушен, например, из‑за повышенной резистентности к лептину или мутации гена лептина.
‡ Липостат . Контур «лептин‑нейропептид Y» обеспечивает поддержание массы жировой ткани тела - липостата (или установочной точки организма в отношении интенсивности энергетического обмена). Помимо лептина, в систему липостата включены инсулин, катехоламины, серотонин, холецистокинин, эндорфины.
† Гипотиреоидный механизм ожирения является результатом недостаточности эффектов йодсодержащих гормонов щитовидной железы. Это снижает интенсивность липолиза, скорость обменных процессов в тканях и энергетические затраты организма.
† Надпочечниковый (глюкокортикоидный, кортизоловый) механизм ожирения активируется вследствие гиперпродукции глюкокортикоидов в коре надпочечников (например, при болезни или синдроме Иценко ‑Кушинга ). Под влиянием избытка глюкокортикоидов активизируется глюконеогенез (в связи с этим развивается гипергликемия), транспорт глюкозы в адипоциты, и гликолиз (происходит торможение липолитических реакций и накопление триглицеридов).
† Инсулиновый механизм развития ожирения развивается вследствие прямой активации инсулином липогенеза в жировой ткани.
† Другие механизмы . Ожирение может развиваться также при других эндокринопатиях (например, при дефиците СТГ и гонадотрофных гормонов). Механизмы развития ожирения при этих состояниях описаны в главе 27 «Эндокринопатии»).
Метаболические механизмы ожирения
† Запасы углеводов в организме относительно малы. Они примерно равны их суточному приёму с пищей. В связи с этим выработался механизм экономии углеводов.
† При повышении в рационе доли жиров скорость окисления углеводов снижается. Об этом свидетельствует соответствующее уменьшение дыхательного коэффициента (отношение скорости образования CO 2 к скорости потребления O 2).
† Если этого не происходит (при расстройстве механизма ингибирования гликогенолиза в условиях высокой концентрации жиров в крови), активируется механизм, обеспечивающий повышение аппетита и увеличение приёма пищи, направленное на обеспечение необходимого количества в организме углеводов.
† В этих условиях жиры накапливаются в виде триглицеридов. Развивается ожирение.
Истощение
Истощение и кахексия - патологическое снижение массы жировой ткани ниже нормы. Одновременно значительно снижается масса мышечной и соединительной ткани.
При истощении дефицит жировой ткани может составлять 20–25% и более (при индексе массы тела ниже 20 кг/м 2), а при кахексии - ниже 50%.
Причины и виды истощения и кахексии
Различают эндогенные и экзогенные причины истощения.
Экзогенные причины
† Вынужденное или осознанное полное либо частичное голодание (в последнем случае чаще всего - с целью похудания).
‡ Полное голодание - состояние, при котором в организм не поступают продукты питания (например, при их отсутствии, отказе от еды, невозможности приёма пищи).
‡ Неполное голодание - состояние, характеризующееся значительным дефицитом пластических веществ и калорий в пище (например, при неполноценном количественно и качественно питании, однородной пище, вегетарианстве).
† Низкая калорийность пищи, не восполняющая энергозатрат организма.
Эндогенные причины
Истощение эндогенного генеза подразделяют на первичное и вторичное.
† Причины первичного (гипоталамического, диэнцефального) истощения рассмотрены на рис. 10–5.
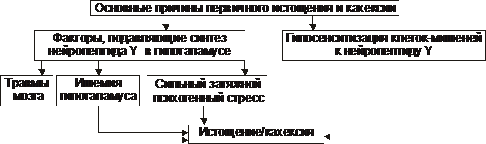
Рис. 10–5. Основные причины первичного истощения и кахексии.
† Причины вторичного (симптоматического) истощения приведены на рис. 10–6.
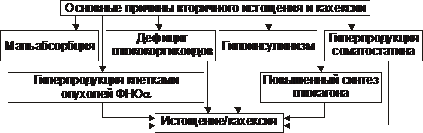
Рис. 10–6. Основные причины вторичного истощения и кахексии.
Патогенез истощения и кахексии
Экзогенное истощение и кахексия . Отсутствие или значительный дефицит продуктов питания приводят к развитию цепи последовательных и взаимозависимых процессов, рассмотренных на рис. 10–7.
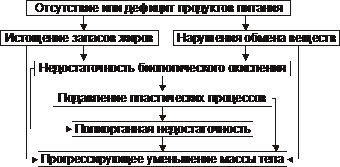
Рис. 10–7. Основные звенья патогенеза экзогенного истощения и кахексии.
Первичные эндогенные формы истощения и кахексии. Наибольшее клиническое значение имеют гипоталамическая, кахектиновая и анорексическая формы.
† Гипоталамическая форма
При гипоталамической (диэнцефальной, подкорковой) форме истощения и кахексии происходит снижение или прекращение синтеза и выделения в кровь нейронами гипоталамуса пептида Y. Это приводит к последовательным процессам, приведенным на рис. 10–8.

Рис. 10–8. Основные звенья гипоталамического механизма истощения и кахексии.
† Кахектиновая форма
Патогенез кахектиновой, или цитокиновой формы истощения и кахексии рассмотрен на рис. 10–9.
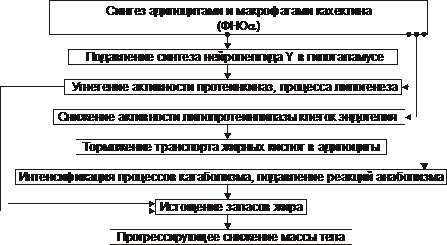
Рис. 10–9. Основные звенья кахектинового механизма истощения и кахексии.
† Анорексическая форма
Основные звенья патогенеза анорексической формы истощения и кахексии представлены на рис. 10–10.
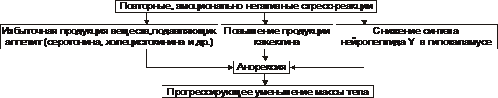
Рис. 10–10. Основные звенья анорексического механизма истощения и кахексии.
‡ У лиц, имеющих предрасположенность к развитию анорексии, критическое отношение к своему телу (воспринимаемому как имеющему избыточную массу) вызывает развитие нервно‑психических расстройств. Это приводит к длительным эпизодам отказа от приёма пищи. Наиболее часто наблюдается у девочек–подростков и девушек до 16–18–летнего возраста.
‡ При повторных и эмоционально негативно окрашенных стресс‑реакциях наблюдается избыточное образование серотонина и холецистокинина, подавляющих аппетит.
‡ Дальнейшее течение процесса может привести к реализации эффектов нейропептида Y и кахектина. Эти факторы, скорее всего, лежат в основе патогенеза нервной анорексии. При затяжном течении процесса развивается выраженное снижение массы тела, вплоть до кахексии.
Вторичные эндогенные формы истощения и кахексии являются важными, нередко - главными, симптомами других патологических состояний и болезней (рис. 10–11).

Рис. 10–11. Основные причины вторичного эндогенного истощения и кахексии.
Липодистрофии
Липодистрофии - состояния, характеризующиеся генерализованной или локальной утратой жировой ткани, реже - избыточным её накоплением в подкожной клетчатке. Причины липодистрофий разнообразны и не всегда известны, от мутаций разных генов (например, ламинов) до постинъекционных осложнений. Существует большая группа наследственных и врождённых синдромов липодистрофий, некоторые из них рассмотрены в статье «Липодистрофии» (приложение «Справочник терминов» на компакт диске).
Липидозы
Липидозы - типовая форма нарушения липидного обмена, характеризующаяся расстройствами метаболизма разных липидов (например, сфинголипидозы, ганглиозидозы, муколипидозы, адренолейкодистрофии, лейкодистрофии, липофусцинозы, цереброзидозы) в клетках (паренхиматозные липидозы), жировой клетчатке (ожирение, истощение) или стенках артериальных сосудов (атеросклероз, артериосклероз). Эти формы липидозов описаны в настоящем учебнике (глава 4 «Повреждение клетки», в данной главе, а также в статьях приложения «Справочник терминов» на компакт диске).
Дислипопротеинемии
Дислипопротеинемии - состояния, характеризующиеся отклонением от нормы содержания, структуры и соотношения в крови различных ЛП. Нарушения метаболизма ЛП - главное звено патогенеза атеросклероза, ИБС, панкреатита и других заболеваний.
Характер течения и клинические проявления дислипопротеинемий определяются:
Наследственными свойствами организма (например, составом, соотношением и уровнем различных ЛП; особенностями их метаболизма).
Факторами внешней среды (например, набором продуктов питания, особенностями рациона и режима приёма пищи).
Наличием (или отсутствием) сопутствующих заболеваний (например, ожирения, гипотиреоза, СД, поражений почек и печени).
Характеристика липопротеинов
В плазме крови циркулируют различные липиды. Свободные жирные кислоты переносятся альбуминами, а триглицериды, холестерин, эфиры холестерина и фосфолипиды, небольшое количество жирных кислот транспортируются в составе ЛП. Эти сферические частицы состоят из гидрофобной сердцевины (содержит эфиры холестерина и триглицериды) и гидрофильной оболочки (содержит холестерин, фосфолипиды и аполипопротеины). Основные характеристики разных ЛП приведены в табл. 10–2.
Таблица 10–2. Виды и основные свойства липопротеинов
|
Хиломикроны | |||||
|
Размер частиц (нм) |
75–1200 | ||||
|
Плотность (г/см 3 ) |
0,98–1,006 |
1,006–1,019 |
1,019–1,063 |
1,063–1,210 |
|
|
Состав (%): | |||||
|
Холестерин | |||||
|
Триглицериды | |||||
|
Фосфолипиды | |||||
|
АпоЛП |
В48, AI, AII, AIV, CI, CII, CIII, E |
B100, CI, CII, CIII, E |
AI, AII, AIV, CI, CII, CIII, E |
||
|
Источник |
Тонкая кишка, липиды пищи |
Печень, тонкая кишка |
ЛПОНП, ЛППП |
Тонкая кишка, печень |
|
|
Атерогенность |
Не доказана |
Не доказана |
Антиатерогенны |
||
Аполипопротеины обеспечивают сохранение упорядоченной структуры мицелл ЛП, взаимодействие ЛП с рецепторами клеток, обмен компонентами между ЛП. Подробная характеристик апоЛП и их дефектов приведена в статье «Дефекты аполипопротеинов» (см. приложение «Справочник терминов» на компакт диске).
Атерогенность липопротеинов
ЛП подразделяют на атерогенные и антиатерогенные (рис. 10–12).

Рис. 10–12. Виды липопротеинов в зависимости от их атерогенности.
Антиатерогенный эффект ЛПВП определяется следующими их свойствами:
† Способностью удалять избыток холестерина из плазматической мембраны клеток, включая эндотелий сосудов, и переносить его в печень, где холестерин удаляется с желчью.
† Более высоким сродством ЛПВП к апоЛП Е- и апоЛП В‑рецепторами по сравнению с ЛПНП. Это определяется высоким содержанием апоЛП Е в ЛПВП. В результате ЛПВП препятствуют захвату клетками частиц, насыщенных холестерином.
Оценка потенциальной атерогенности ЛП крови проводится путём расчёта холестеринового коэффициента атерогенности:
В норме холестериновый коэффициент атерогенности не превышает 3,0. При увеличении этого значения риск развития атеросклероза нарастает.
Виды дислипопротеинемий
Основные виды дислипопротеинемий приведены на рис. 10–13.

Рис. 10–13. Виды дислипопротеинемий.
Более 30% первичных дислипопротеинемий - унаследованные формы патологии (как моногенные, так и полигенные с многофакторным генезом).
Около 70% дислипопротеинемий считаются приобретёнными. Вторичные (приобретённые) дислипопротеинемии представляют собой симптомы других болезней. Они сопровождают многие болезни человека (табл. 10–3).
Таблица 10–3. Наиболее частые патологические процессы, приводящие к развитию вторичных дислипопротеинемий
|
Заболевание |
Механизм развития |
|
|
Сахарный диабет |
I , IV , V |
Снижение активности ЛПЛазы, избыточный приток жирных кислот в печень, усиление синтеза ЛПОНП |
|
Нарушение секреции липидов |
||
|
Первичный цирроз печени |
Нарушение синтеза ЛП |
|
|
Нефротический синдром |
II , IV , V |
Повышенное образование ЛП и триглицеридов |
|
Гипотиреоз |
II , IV | |
|
Гипофизарная недостаточность |
Пониженный катаболизм липидов |
|
|
Хронический алкоголизм |
IV , V |
Снижение активности ЛПЛазы, повышенный синтез ЛП |
Различные наследственные дефекты, а также приобретённые патологические процессы и болезни часто приводят к сходным изменениям содержания и профиля различных ЛП. В связи с этим требуется тонкая дифференцировка их происхождения, позволяющая проводить их эффективное лечение.
Гиперлипопротеинемии
Гиперлипопротеинемии - состояния характеризующиеся расстройством образования, транспорта и обмена ЛП и проявляющиеся стойким повышением в плазме крови содержания холестерина и/или триглицеридов.
Классификация
В 1967 г. Фредриксон с соавторами разработал классификацию гиперлипопротеинемий (гиперлипидемий). В основу были положены данные о содержании общего холестерина и триглицеридов в плазме крови, а также особенности распределения фракций ЛП при их электрофорезе и ультрацентрифугировании. На этом основании было выделено пять типов гиперлипопротеинемий. Позднее эта классификация была пересмотрена специалистами ВОЗ (табл. 10–4).
Нарушения и их причины по алфавиту:
нарушение липидного обмена -
Целый ряд заболеваний обусловлен нарушением липидного обмена . Важнейшими среди них следует назвать атеросклероз и ожирение . Заболевания сердечно-сосудистой системы, как следствие атеросклероза, занимают первое место в структуре смертности в мире. Одно из самых распространенных проявлений атеросклероза - поражение коронарных сосудов сердца. Аккумуляция холестерина в стенках сосудов приводит к образованию атеросклеротических бляшек. Они, увеличиваясь со временем в размере, могут перекрывать просвет сосуда и препятствовать нормальному кровотоку. Если вследствие этого кровоток нарушается в коронарных артериях, то возникает стенокардия или инфаркт миокарда . Предрасположенность к атеросклерозу зависит от концентрации транспортных форм липидов крови альфа-липопротеинов плазмы.
При каких заболеваниях возникает нарушение липидного обмена:
Аккумуляция холестерола (ХС) в сосудистой стенке происходит вследствие дисбаланса между поступлением его в интиму сосудов и его выходом. В результате такого дисбаланса холестерол там накапливается. В центрах накопления холестерола формируются структуры - атеромы. Наиболее известны два фактора, которые вызывают нарушение липидного обмена.
1. Во-первых, это изменения частиц ЛПНП (гликозилирование, перекисное окисление липидов, гидролиз фосфолипидов, окисление апо В). Поэтому они захватываются специальными клетками - "мусорщиками" (главным образом, макрофагами). Захват липопротеиновых частиц с помощью "мусорных" рецепторов протекает бесконтрольно. В отличие от апо В/Е - опосредованного эндоцитоза это не вызывает регуляторных эффектов, направленных на снижение поступления в клетку ХС, описанных выше. В результате макрофаги переполняются липидами, теряют функцию поглощения отходов и превращаются в пенистые клетки. Последние задерживаются в стенке кровеносных сосудов и начинают секретировать факторы роста, ускоряющие клеточное деление. Возникает атеросклеротическая пролиферация клеток.
2. Во-вторых, это неэффективное высвобождение холестерола из эндотелия сосудистой стенки циркулирующими в крови ЛПВП.
Факторы, влияющие на повышенный уровень ЛПНП у человека
Пол - у мужчин выше, чем у женщин в пременопаузе, и ниже, чем у женщин в постменопаузе
- Старение
- Насыщенные жиры в диете
- Высокое потребление холестерина
- Диета с низким содержанием грубых волокнистых продуктов
- Потребление алкоголя
- Беременность
- Ожирение
- Диабет
- Гипотиреоз
- Болезнь Кушинга
- Уремия
- Нефроз
- Наследственные гиперлипидемии
Нарушения липидного обмена (дислипидемии) , характеризующиеся в первую очередь повышенным содержанием в крови холестерина и триглицеридов, являются важнейшими факторами риска атеросклероза и связанных с ним заболеваний сердечно-сосудистой системы. Концентрация в плазме крови общего холестерина (ХС) или его фракций, тесно коррелирует с заболеваемостью и смертностью от ИБС и других осложнений атеросклероза. Поэтому характеристика нарушений липидного обмена является обязательным условием эффективной профилактики сердечно-сосудистых заболеваний.
Нарушение липидного обмена может быть первичными и вторичными и характеризуются только повышением содержания холестерина (изолированная гиперхолестеринемия), триглицеридов (изолированная гипертриглицеридемия), триглицеридов и холестерина (смешанная гиперлипидемия).
Первичное нарушение липидного обмена детерминировано единичными или множественными мутациями соответствующих генов, в результате которых наблюдается гиперпродукция или нарушение утилизации триглицеридов и холестерина ЛПНП или гиперпродукция и нарушения клиренса ЛПВП.
Первичное нарушение липидного обмена можно диагностировать у пациентов с клиническими симптомами этих нарушений, при раннем начале атеросклероза (до 60 лет), у лиц с семейным анамнезом атеросклероза или при повышении содержания холестерина сыворотки > 240 мг/дл (> 6,2 ммоль/л).
Вторичное нарушение липидного обмена возникает, как правило, у населения развитых стран в результате малоподвижного образа жизни, потребления пищи, содержащей большое количество холестерина, насыщенных жирных кислот.
Другими причинами вторичного нарушения липидного обмена могут быть:
1. Сахарный диабет.
2. Злоупотребление алкоголя.
3. Хроническая почечная недостаточность.
4. Гипертиреоидизм.
5. Первичный билиарный цирроз.
6. Прием некоторых препаратов (бета-блокаторы, антиретровирусные препараты, эстрогены, прогестины, глюкокортикоиды).
Наследственные нарушения липидного обмена:
У небольшого числа людей наблюдаются наследственные нарушения обмена липопротеинов, проявляющиеся в гипер- или гиполипопротеинемии. Причиной их является нарушение синтеза, транспорта или расщепления липопротеинов.
В соответствии с общепринятой классификацией, различают 5 типов гиперлипопротеинемий.
1. Существование 1 типа обусловлено недостаточной активностью ЛПЛ. Вследствие этого из кровотока очень медленно выводятся хиломикроны. Они накапливаются в крови, выше нормы отмечается и уровень ЛПОНП.
2. Гиперлипопротеинемия 2 типа делится на два подтипа: 2а, характеризующийся высоким содержанием в крови ЛПНП, и 2б (увеличение ЛПНП и ЛПОНП). 2 тип гиперлипопротеинемий проявляется высокой, а в ряде случаев очень высокой, гиперхолестеролемией с развитием атеросклероза и ишемической болезни сердца. Содержание триацилглицеролов в крови в пределах нормы (2а тип) или умеренно повышенное (2б тип). Гиперлипопротеинемия 2 типа характерна для тяжёлого заболевания - наследственной гиперхолестеролемии, поражающей молодых людей. В случае гомозиготной формы оно заканчивается смертельным исходом в молодом возрасте от инфарктов миокарда, инсультов и других осложнений атеросклероза. Гиперлипопротеинемия 2 типа распространена широко.
3. При гиперлипопротеинемии 3 типа (дисбеталипопротеинемии) нарушается превращение ЛПОНП в ЛПНП, и в крови появляются патологические флотирующие ЛПНП или ЛПОНП. В крови увеличено содержание холестерола и триацилглицеролов. Этот тип встречается достаточно редко.
4. При 4 типе гиперлипопротеинемий основное изменение заключается в увеличении ЛПОНП. В результате в сыворотке крови значительно увеличено содержание триацилглицеролов. Сочетается с атеросклерозом коронарных сосудов, ожирением, сахарным диабетом. Развивается главным образом у взрослых людей и является весьма распространённым.
5. 5 тип гиперлипопротеинемии – увеличение в сыворотке крови содержания ХМ и ЛПОНП, связанное с умеренно пониженной активностью липопротеинлипазы. Концентрация ЛПНП и ЛПВП ниже нормы. Содержание триацилглицеролов в крови повышено, в то время как концентрация холестерола в пределах нормы или умеренно повышена. Встречается у взрослых людей, но широкого распространения не имеет.
Типирование гиперлипопротеинемий проводится в лаборатории на основании исследования содержания в крови различных классов липопротеинов фотометрическими методами.
Большей информативностью в качестве предсказателя атеросклеротического поражения коронарных сосудов обладает показатель холестерола в составе ЛПВП. Еще более информативными является коэффициент, отражающий отношение атерогенных ЛП к антиатерогенным.
Чем выше этот коэффициент, тем больше опасность возникновения и прогрессирования заболевания. У здоровых лиц он не превышает 3-3,5 (у мужчин выше, чем у женщин). У больных ИБС он достигает 5-6 и более единиц.
Диабет – болезнь липидного обмена?
Проявления нарушения обмена липидов настолько сильно выражены при диабете, что диабет часто называют больше болезнью липидного, чем углеводного обмена. Основные нарушения обмена липидов при диабете – усиление распада липидов, увеличение образования кетоновых тел и снижение синтеза жирных кислот и триацилглицеролов.
У здорового человека обычно 50%поступившей глюкозы распадается CO2 и H2O; около 5 % преобразуется в гликоген, а остальная часть превращается в липиды в жировых депо. При диабете лишь 5 % глюкозы превращается в липиды при том, что количество распадающейся до CO2 и H2O глюкозы также уменьшается, а количество преобразуемой в гликоген изменяется незначительно. Результатом нарушения потребления глюкозы становится повышение уровня глюкозы в крови и удаление ее с мочой. Внутриклеточный дефицит глюкозы приводит к снижению синтеза жирных кислот.
У больных, не получающих лечения наблюдается увеличение в плазме содержания триацилглицеролов и хиломикронов и плазма часто является липемической. Повышение уровня этих компонентов вызывает уменьшение липолиза в жировых депо. Понижение активности липопротеинлипазы дополнительно вносит вклад в снижение липолиза.
Перекисное окисление липидов
Особенностью липидов клеточных мембран является их значительная ненасыщенность. Ненасыщенные жирные кислоты легко подвергаются перекисной деструкции – ПОЛ (перекисное окисление липидов). Реакция мембраны на повреждение называется поэтому «пероксидным стрессом».
В основе ПОЛ лежит свободнорадикальный механизм.
Свободнорадикальная патология – это курение, рак, ишемия, гипероксия, старение, диабет, т.е. практически при всех заболеваниях имеет место неконтролируемое образование свободных радикалов кислорода и интенсификация ПОЛ.
Клетка имеет системы защиты от свободнорадикального повреждения. Антиоксидантная система клеток и тканей организма включает 2 звена: ферментативное и неферментативное.
Ферментативные антиоксиданты:
- СОД (супероксиддисмутаза) и церулоплазмин, участвующие в обезвреживании свободных радикалов кислорода;
- каталаза, катализирующая разложение пероксида водорода; система глутатиона, обеспечивающая катаболизм перекисей липидов, перекисно модифицированных нуклеотидов и стероидов.
Даже кратковременный недостаток неферментативных антиоксидантов, особенно витаминов антиоксидантного действия (токоферола, ретинола, аскорбата), приводит к стойким и необратимым повреждениям клеточных мембран.
К каким врачам обращаться, если возникает нарушение липидного обмена:
Вы заметили нарушение липидного обмена? Вы хотите узнать более детальную информацию или же Вам необходим осмотр? Вы можете записаться на прием к доктору – клиника Euro lab всегда к Вашим услугам! Лучшие врачи осмотрят Вас, изучат внешние признаки и помогут определить болезнь по симптомам, проконсультируют Вас и окажут необходимую помощь. Вы также можете вызвать врача на дом . Клиника Euro lab открыта для Вас круглосуточно.симптомам заболеваний и не осознают, что эти болезни могут быть жизненно опасными. Есть много болезней, которые по началу никак не проявляют себя в нашем организме, но в итоге оказывается, что, к сожалению, их уже лечить слишком поздно. Каждое заболевание имеет свои определенные признаки, характерные внешние проявления – так называемые симптомы болезни . Определение симптомов – первый шаг в диагностике заболеваний в целом. Для этого просто необходимо по несколько раз в год проходить обследование у врача , чтобы не только предотвратить страшную болезнь, но и поддерживать здоровый дух в теле и организме в целом.
Если Вы хотите задать вопрос врачу – воспользуйтесь разделом онлайн консультации , возможно Вы найдете там ответы на свои вопросы и прочитаете советы по уходу за собой . Если Вас интересуют отзывы о клиниках и врачах – попробуйте найти нужную Вам информацию на . Также зарегистрируйтесь на медицинском портале Euro lab , чтобы быть постоянно в курсе последних новостей и обновлений информации на сайте, которые будут автоматически высылаться Вам на почту.
Карта симптомов предназначена исключительно для образовательных целей. Не занимайтесь самолечением; по всем вопросам, касающимся определения заболевания и способов его лечения, обращайтесь к врачу. EUROLAB не несет ответственности за последствия, вызванные использованием размещенной на портале информации.
Если Вас интересуют еще какие-нибудь симптомы болезней и виды нарушений или у Вас есть какие-либо другие вопросы и предложения – напишите нам , мы обязательно постараемся Вам помочь.

